题目内容
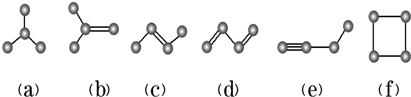
14.下面的原子或原子团不属于官能团的是( )| A. | NO3- | B. | -Cl | C. | -OH | D. |  |
分析 决定有机物化学性质的原子或原子团称为官能团,常见的官能团有:碳碳双键、碳碳三键、羟基、羧基、卤素原子、酯基等,注意烃基不属于官能团,据此进行解答.
解答 解:A.NO3-为硝酸根离子,不属于官能团,故A选;
B.-Cl为卤素原子,为官能团,故B不选;
C.-OH为羟基,为醇类和酚类的官能团,故C不选;
D. 为醛基,属于醛类的官能团,故D不选;
为醛基,属于醛类的官能团,故D不选;
故选A.
点评 本题考查了烃的衍生物的官能团的判断,试题注重了基础知识的考查,题目难度不大,注意掌握官能团的概念,明确常见的烃的衍生物的官能团类型及具有的化学性质.

练习册系列答案
相关题目
7.对于常温下0.0l mol/L的氨水,下列叙述正确的是( )
| A. | c(H+)+c(NH4+)=2c(OH-) | |
| B. | 由H2O电离出的c(H+)=1.0×10-12mol•L-1 | |
| C. | 与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3•H2O)=0.02 mol•L-1 | |
| D. | 与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3•H2O)=c(H+) |
5.根据下列物质的化学性质,判断其应用错误的是( )
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
9.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)?C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1].然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3].
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
3.下表是元素周期表的一部分,针对表中的①~=10 ⑩中元素,填空回答以下问题:
(1)在这些元素中,室温下其单质为液态的元素在上表中对应的“序号”是⑩,其原子的原子结构示意图为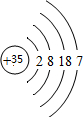 ;
;
(2)元素的最高价氧化物对应的水化物中酸性最强的是(填物质化学式,下同)HClO4,碱性最强的是KOH,
(3)②⑧⑩三种元素的氢化物中沸点最低的是(填氢化物化学式)HCl.
(4)室温下,其单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,此元素在上表中对应的“序号”是⑤,其单质是能与NaOH溶液反应生成H2的“非金属”,该元素在上表中对应的“序号”是⑥,此反应的化学方程式是:Si+2NaOH+H2O=Na2SiO3+2H2↑,
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,离子半径最小的序号是⑤;
(6)⑦与⑩不在同一周期,也不在同族,但可通过一个化学反应判断出其阴离子还原性的强弱,此反应的离子方程式为:Br2+S2-═2Br-+S.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)元素的最高价氧化物对应的水化物中酸性最强的是(填物质化学式,下同)HClO4,碱性最强的是KOH,
(3)②⑧⑩三种元素的氢化物中沸点最低的是(填氢化物化学式)HCl.
(4)室温下,其单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,此元素在上表中对应的“序号”是⑤,其单质是能与NaOH溶液反应生成H2的“非金属”,该元素在上表中对应的“序号”是⑥,此反应的化学方程式是:Si+2NaOH+H2O=Na2SiO3+2H2↑,
(5)在②③④⑤⑦⑧元素中,原子半径最大的序号是⑧,离子半径最小的序号是⑤;
(6)⑦与⑩不在同一周期,也不在同族,但可通过一个化学反应判断出其阴离子还原性的强弱,此反应的离子方程式为:Br2+S2-═2Br-+S.