题目内容
2.氯化亚铜(化学式为CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇;在空气中迅速被氧化,风光则分解.某实验小组用工业废液(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,设计流程如: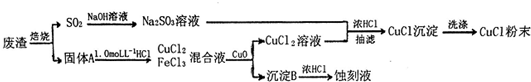
根据以上信息回答下列问题:
(1)固体A的成分为Fe2O3和CuO,为提高固体A的溶解速率,可采取的措施是将固体A粉碎为粉末(任写一种).
(2)沉淀B为Fe(OH)3,不宜将沉淀剂CaO改为NaOH溶液,其理由是避免Cu2+反应生成沉淀.
(3)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀,写出该反应的离子方程式2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢,CuCl沉淀的洗涤剂应选用乙醇以减少沉淀的溶解损失,所得CuCl粉末应密封在真空或充有氮气的避光装置中保存.
(4)熔融态氯化亚铜时快时导电性差,实验测得氯化亚铜蒸汽的相对分子质量为199,则氯化亚铜分子式为Cu2Cl2,属共价(填:共价或离子)化合物.
(5)氯化亚铜在热水中迅速与水反应生成砖红色固体,写出该反应的化学方程式2CuCl+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+2HCl.
分析 用工业废液(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,废液焙烧硫化亚铜生成氧化铜、二氧化硫,二氧化硫通入氢氧化钠溶液吸收得到亚硫酸钠溶液,固体A主要为氧化铜和氧化铁,加入稀盐酸溶解得到氯化铁溶液和氯化铜溶液,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液和沉淀B为氢氧化铁,亚硫酸钠溶液和氯化铜溶液加入浓盐酸抽滤得到氯化亚铜沉淀,洗涤得到固体粉末,沉淀B是氢氧化铁溶解于浓盐酸得到蚀刻液,
(1)分析可知固体A为硫化亚铜焙烧和氧气反应生成的氧化铜和原废液中的氧化铁;提高溶解速率可以增大接触面积,升高温度等措施;
(2)沉淀B是溶液中氯化铁加入氧化铜调节溶液PH促进铁离子水解彻底生成氢氧化铁沉淀;
(3)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀发生氧化还原反应;氯化亚铜微溶于水、不溶于乙醇分析选择洗涤剂,在空气中迅速被氧化,见光则分解,应避免接触空气,遮光保存;
(4)实验测得氯化亚铜蒸汽的相对分子质量为199,结合实验室为CuCl计算得到化学式,熔融态氯化亚铜时快时导电性差说明是共价化合物;
(5)氯化亚铜在热水中迅速与水反应生成砖红色固体为氧化亚铜,结合原子守恒配平书写化学方程式.
解答 解:用工业废液(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,废液焙烧硫化亚铜生成氧化铜、二氧化硫,二氧化硫通入氢氧化钠溶液吸收得到亚硫酸钠溶液,固体A主要为氧化铜和氧化铁,加入稀盐酸溶解得到氯化铁溶液和氯化铜溶液,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液和沉淀B为氢氧化铁,亚硫酸钠溶液和氯化铜溶液加入浓盐酸抽滤得到氯化亚铜沉淀,洗涤得到固体粉末,沉淀B是氢氧化铁溶解于浓盐酸得到蚀刻液,
(1)固体A是硫化亚铜焙烧与氧气反应生成的氧化铜CuO和原废液中的氧化铁Fe2O3的混合物,提高溶解速率可以增大接触面积,把A固体粉碎,升高温度等措施,
故答案为:CuO;将固体A粉碎为粉末或升温等;
(2)沉淀B是溶液中氯化铁加入氧化铜调节溶液PH促进铁离子水解彻底生成氢氧化铁沉淀,不宜将沉淀剂CuO改为NaOH溶液,其理由是避免铜离子沉淀,
故答案为:Fe(OH)3;避免Cu2+反应生成沉淀;
(3)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀发生氧化还原反应,反应的离子方程式为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;氯化亚铜微溶于水、不溶于乙醇分析选择乙醇洗涤剂,氯化亚铜在空气中迅速被氧化,见光则分解,应避免接触空气,遮光保存,所得CuCl粉末应密封在真空或充有N2的避光装置中保存,
故答案为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;乙醇;N2;
(4)实验测得氯化亚铜蒸汽的相对分子质量为199,结合实验室为CuCl计算(CuCl)n=199,n=2得到化学式Cu2Cl2,熔融态氯化亚铜时快时导电性差说明是共价化合物,
故答案为:Cu2Cl2;共价;
(5)氯化亚铜在热水中迅速与水反应生成砖红色固体为氧化亚铜,结合原子守恒配平书写化学方程式为:2CuCl+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+2HCl,
故答案为:2CuCl+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+2HCl.
点评 本题考查了物质的分离提纯实验过程分析判断、题干信息的应用、氧化还原反应产物的分析及其离子和化合物性质的理解应用等知识点,题目难度中等.

| A. | NO3- | B. | -Cl | C. | -OH | D. |  |
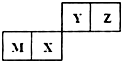
| A. | M与Z形成的化合物中只存在离子键 | |
| B. | X的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 原子半径Z>Y | |
| D. | M的最高价氧化物对应水化物能与NaOH溶液反应 |
| 物质 | X | Y | Z |
| 初始物质的量/mol | 2 | 4 | 0 |
| 4 min末物质的量/ihol | 1.6 | 2.8 | a |
| 平衡物质的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃该反应的平衡常数为4 | |
| C. | 前4min内,用Z的变化量表示的平均反应速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的体系温度,V逆:增大,V正增大,平衡向逆反应方向移动 |
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,5-二甲基-3-乙基己烷 |
 )与P(
)与P( ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )| A. | 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3:1 | |
| B. | 二者在NaOH醇溶液中均可发生消去反应 | |
| C. | 一定条件下,二者在NaOH溶液中均可发生取代反应 | |
| D. | Q的一氯代物只有1种,P的一溴代物有2种 |

 .
. .
.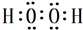 ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.
,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O. A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构. ,CB2的电子式为
,CB2的电子式为 .
.