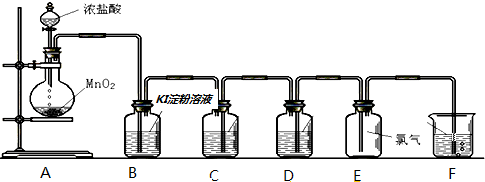
题目内容
8.次磷酸(H3PO2)可发生下列反应而用于化学镀银.4Ag++1H3PO2+2H2O-4Ag+1H3PO4+4H+
试回答下列问题:
①配平该离子反应方程式.
②若反应中生成5.4g Ag,则转移电子个数为0.05NA.
分析 该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,根据转移电子守恒、电荷守恒及原子守恒配平方程式;
n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,根据Ag++e-→Ag计算转移电子的数目.
解答 解:①该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,根据转移电子守恒、电荷守恒及原子守恒配平方程式为4Ag++1H3PO2+2H2O=4Ag+1H3PO4+4H+,
故答案为:4;1;2;4;1;4;
②n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,
Ag++e-→Ag
1 1
单位mol:0.05 0.05
0.05mol×NAmol-1=0.05NA,
故答案为:0.05NA.
点评 本题考查氧化还原反应有关知识,为高频考点,涉及氧化还原反应方程式配平、转移电子数的计算,难度中等,明确化合价的变化和氧化还原反应原理是解题的关键.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
18.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知( )
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
19.下列有机物的同分异构体(不含环状结构)数目为5的是( )
| A. | 丙酸乙酯 | B. | C4H9Cl | C. | 己酸 | D. | 戊烯 |
16.有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径①:S$\stackrel{浓硝酸}{→}$H2SO4
途径②S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4.
途径①:S$\stackrel{浓硝酸}{→}$H2SO4
途径②S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4.
| A. | 途径①反应中体现了浓硝酸的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 | |
| C. | 由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 | |
| D. | 途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
3.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为 2Fe+2H2O+O2═2Fe(OH)2.以下说法正确的是( )
| A. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 | |
| B. | 正极发生的反应为 2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 负极发生的反应为 Fe-2e-═Fe2+ |
13.下列有机物命名正确的是( )
| A. | 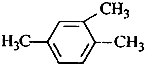 1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. | 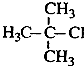 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | |
| C. | 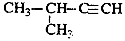 2-甲基-3-丁炔 2-甲基-3-丁炔 | |
| D. | CH3CH2C(CH3)2CH(C2H5)CH3 3,3,4-三甲基已烷 |
17.下列各组离子在常温下一定能大量共存的是( )
| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
18.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |