题目内容
17.下列各组离子在常温下一定能大量共存的是( )| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
分析 A.pH=0,溶液显酸性,Fe2+为浅绿色;
B.离子之间结合生成络离子;
C.加入铝粉能放出H2的溶液,为非氧化性酸或强碱溶液;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性.
解答 解:A.pH=0,溶液显酸性,该组离子之间不反应,但Fe2+为浅绿色,与无色不符,故A错误;
B.Fe3+、SCN-结合生成络离子,不能大量共存,故B错误;
C.加入铝粉能放出H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Mg2+、NH4+,酸溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,故C错误;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
5.Na2S2O3可用作照相的定影剂等.已知Na2S2O3的某些性质如下:
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4.
实验室可用如下装置(略去部分夹持仪器)模仿生成过程.
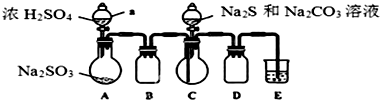
实验步骤:(1)仪器组装完成后,关闭A、C中分液漏斗活塞,将E中导管伸入盛水的水槽中,微热A中圆底烧瓶,E中导管口有气泡冒出,停止加热,导管中回流一段稳定的水柱,则整个装置气密性良好.装置D的作用是防止倒吸,装
置E中溶液的作用是吸收多余的SO2.
(2)先向C中烧瓶加入Na2CO3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)等Na2CO3和Na2S完全消耗后,结束反应.过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品.
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整.
(5)利用KMnO4标准溶液可以定量测定硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol•L-1KMnO4标准溶液,加硫酸酸化,再加过量KI溶液.写出该反应的离子反应:2MnO4-+16H++10I-═5I2+2Mn2++8H2O
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,滴定3次.指示剂最好选用淀粉溶液,本次滴定时所用的玻璃仪器除锥形瓶外,还有碱式滴定管.
④若3次滴定NaS2O3溶液的平均用量为12.00mL,则样品的纯度为65.8%.
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4.
实验室可用如下装置(略去部分夹持仪器)模仿生成过程.

实验步骤:(1)仪器组装完成后,关闭A、C中分液漏斗活塞,将E中导管伸入盛水的水槽中,微热A中圆底烧瓶,E中导管口有气泡冒出,停止加热,导管中回流一段稳定的水柱,则整个装置气密性良好.装置D的作用是防止倒吸,装
置E中溶液的作用是吸收多余的SO2.
(2)先向C中烧瓶加入Na2CO3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)等Na2CO3和Na2S完全消耗后,结束反应.过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品.
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整.
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3:静置后取上清液,加入BaCl2溶液 |
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol•L-1KMnO4标准溶液,加硫酸酸化,再加过量KI溶液.写出该反应的离子反应:2MnO4-+16H++10I-═5I2+2Mn2++8H2O
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,滴定3次.指示剂最好选用淀粉溶液,本次滴定时所用的玻璃仪器除锥形瓶外,还有碱式滴定管.
④若3次滴定NaS2O3溶液的平均用量为12.00mL,则样品的纯度为65.8%.
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 64gCaC2晶体中阴离子数目是2NA | |
| B. | 36g冰晶体中氢键数目是4NA | |
| C. | pH=13的NaOH溶液中阴阳离子总数目为0.2NA | |
| D. | 1L0.1mol•L-1FeCl3溶液中Fe3+水解产生的H+数目为0.3NA |
9.化学与生产、生活息息相关,下列说法不正确的是( )
| A. | 误食重金属盐可立即喝鲜牛奶或鸡蛋清解毒 | |
| B. | 硅是人类将太阳能转换为电能的常用材料 | |
| C. | Al(OH)3可用来治疗胃酸过多,其原因是发生了氧化还原反应 | |
| D. | 高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水 |
6.除去下列溶液中的杂质(括号内是杂质)所用试剂正确的是( )
| A. | NaOH溶液(Ba(OH)2):用K2SO4溶液 | B. | NaCl溶液(Na2SO4):用Ba(NO3)2溶液 | ||
| C. | KOH溶液K2CO3:用CaCl2溶液 | D. | HNO3溶液(HCl):用AgNO3溶液 |
7.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 工业上用惰性电极电解熔融的MgO可制得Mg | |
| B. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| C. | 草木灰可与铵态氮肥混合施用 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
 .
.