题目内容
4.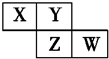 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
分析 这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期而Z、W位于第三周期,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,则X是N元素、Z是S元素、W是Cl元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.如果氢化物水溶液呈酸性,氢化物在水溶液中电离程度越大,该溶液酸性越强;
D.氢化物的相对分子质量越大,且含有氢键的物质熔沸点越高.
解答 解:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期而Z、W位于第三周期,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,则X是N元素、Z是S元素、W是Cl元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:Z>W>X>Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性W>Z,所以其最高价氧化物的水化物酸性W>Z,故B错误;
C.如果氢化物水溶液呈酸性,氢化物在水溶液中电离程度越大,该溶液酸性越强,X的氢化物溶液呈碱性、Y溶液呈中性、W氢化物水溶液呈酸性,所以气态氢化物溶液的pH:X>Y>W,故C正确;
D.氢化物的相对分子质量越大,且含有氢键的物质熔沸点越高,Y氢化物中含有氢键而Z氢化物中不含氢键,所以Y的氢化物的沸点高于同族元素Z的氢化物的沸点,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素或物质性质是解本题关键,注意规律中的反常现象,易错选项是C,注意氢化物的稳定性与化学键有关,氢化物的熔沸点与相对分子质量和氢键有关.

练习册系列答案
相关题目
14.某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期金属元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
(3)写出实验①和④对应化学方程式
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
19.液氨是富氢物质,是氢能的理想载体.下列说法不正确的是( )
| A. | NH3分子中氮原子的轨道杂化方式为sp3杂化 | |
| B. | [Cu(NH3)4]2+中,NH3分子是配体 | |
| C. | NH4+与PH4+、CH4、BH4-互为等电子体 | |
| D. | 相同压强下,NH3沸点比PH3的沸点低 |
16.核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中正确的是( )
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |

 ;
; .
. .
.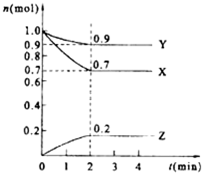 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 2Z;
2Z;