题目内容
19.液氨是富氢物质,是氢能的理想载体.下列说法不正确的是( )| A. | NH3分子中氮原子的轨道杂化方式为sp3杂化 | |
| B. | [Cu(NH3)4]2+中,NH3分子是配体 | |
| C. | NH4+与PH4+、CH4、BH4-互为等电子体 | |
| D. | 相同压强下,NH3沸点比PH3的沸点低 |
分析 A.氨气分子中氮原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以N原子采用sp3杂化;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
C.等电子体为原子数相等和价电子数相等的原子团;
D.NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但分子间氢键能增大物质的沸点.
解答 解:A.氨气分子中氮原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以N原子采用sp3杂化,故A正确;
B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,N原子提供孤电子对,所以N原子是配位原子,NH3分子是配体,故B正确;
C.等电子体为原子数相等和价电子数相等的原子团,NH4+与PH4+、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,属于等电子体,故C正确;
D.NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点,氨气存在分子间氢键,所以相同压强时,NH3和PH3比较,氨气沸点高,故D错误.
故选:D.
点评 本题综合考查物质的结构与性质知识,侧重于杂化类型、氢键、配位键等知识,题目难度中等,注意把握杂化类型的判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
7.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
14. 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能与溴水发生取代反应;⑦能与碳酸钠溶液反应;⑧1mol该有机物可与2mol的钠完全反应,生成1mol氢气.
 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能与溴水发生取代反应;⑦能与碳酸钠溶液反应;⑧1mol该有机物可与2mol的钠完全反应,生成1mol氢气.
| A. | ①④ | B. | ②⑤ | C. | ②⑥ | D. | 只有⑥ |
4.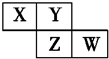 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
8.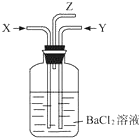 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 在Z导管口有红棕色气体出现 | |
| B. | 洗气瓶中产生的沉淀是BaCO3和BaSO3的混合物 | |
| C. | 洗气瓶中产生的沉淀是BaSO3 | |
| D. | 在Z导管出来的气体中无CO2 |
9.下列各组顺序的排列不正确的是( )
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
 .
.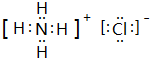 ,A2C2的电子式为
,A2C2的电子式为 .
.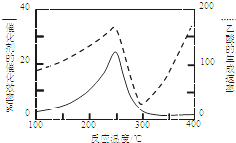 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.