题目内容
14.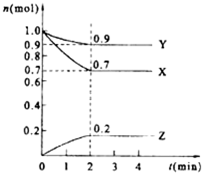 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.(1)由图中所给数据进行分析,该反应的化学方程式为3X+Y
 2Z;
2Z;(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol/(L•min);
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时增大(填增大、减小或无变化,下同);混合气体密度比起始时不变.
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b=5:3.
(5)下列措施能加快反应速率的是CEF.
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度 F.选择高效的催化剂
(6)下列说法正确的是AC.
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率v(Z);
(3)混合气体的平均相对分子质量M=$\frac{m}{n}$,混合气体密度ρ=$\frac{m}{V}$来判断;
(4)根据化学反应中的三行式进行计算;
(5)根据影响化学反应速率的因素分析,升温、增压等均能加快反应速率;
(6)A.反应伴随能量变化,升高温度改变化学反应的限度;
B.升高温度正逆反应速率均加快;
C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关;
D.化学反应的限度与反应物性质和外部因素有关,是可能改变的;
E.增大Y的浓度,正反应速率加快,逆反应速率同时加快.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y  2Z,
2Z,
故答案为:3X+Y  2Z;
2Z;
(2)在2min时间内,用Z表示反应的平均速率v(Z)=$\frac{△c(Z)}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)混合气体的平均相对分子质量M=$\frac{m}{n}$,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ=$\frac{m}{V}$,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:增大;不变;
(4)3X+Y?2Z(设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n (X)=n (Y)=n (Z)时,a-3x=b-x=2x,则a=5x,b=3x,所以原混合气体中a:b=5:3,
故答案为:5:3;
(5)A.恒压时充入He,体系分压减小,反应速率减小,故错误;
B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故错误;
C.恒容时充入X,X的浓度增大,反应速率加快,故正确;
D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故错误;
E.升高温度,任何化学反应速率加快,故正确;
F.选择高效的催化剂,反应速率加快,故正确,
故答案为:CEF;
(6)A.反应伴随能量变化,升高温度改变化学反应的限度,故正确;
B.升高温度正逆反应速率均加快,故错误;
C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关,故正确;
D.化学反应的限度与反应物性质和外部因素有关,是可能改变的,故错误;
E.增大Y的浓度,正反应速率加快,逆反应速率同时加快,故错误,
故答案为:AC.
点评 本题涉及化学平衡的建立、化学平衡状态的判断以及有关化学反应速率和三行式的计算知识,属于综合知识的考查,难度不大.

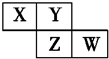 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
| A. | Penguinone分子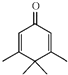 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解 |
相关资料
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
实验过程
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
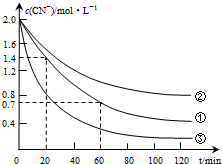
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
 .有机物X的键线式为
.有机物X的键线式为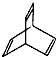
 .
.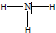 .
.