题目内容
16.核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中正确的是( )| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
分析 根据核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,符合题意;n=3时,最外层电子数为7,质子数为17,符合题意,以此来解答.
解答 解:A、氮和氯的最高价分别为:5和7,故A错误;
B、氯的最低负价为-1价,故B正确;
C、氮和氯的氢化物都溶于水,但氮的氢化物的水溶液呈碱性,故C错误;
D、氮和氯最高价氧化物对应水化物分别是硝酸和高氯,酸都是强酸,故D错误;
故选B.
点评 本题考查原子结构中电子层数、最外层电子数、质子数的关系,利用假设法令n分别为1、2、3来讨论即可解答,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案
相关题目
6.下列物质用途错误的是( )
| A. | 天然气用做燃料 | B. | 无水乙醇直接用作医用消毒 | ||
| C. | 苯酚用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
7.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
4.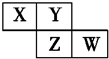 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
1.下列有机化合物的一氯取代物的同分异构体的数目相等的是( )


| A. | ①② | B. | ②④ | C. | ③④ | D. | ①④ |
8.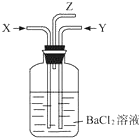 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 在Z导管口有红棕色气体出现 | |
| B. | 洗气瓶中产生的沉淀是BaCO3和BaSO3的混合物 | |
| C. | 洗气瓶中产生的沉淀是BaSO3 | |
| D. | 在Z导管出来的气体中无CO2 |
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.