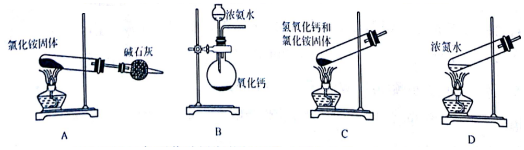
题目内容
11.下列说法正确的是( )| A. | 电解精炼铜时,粗铜与外接电源的负极相连 | |
| B. | 纯水中c(H+)=5×10-7mol•L-1,则c(OH-)=2×10-8mol•L-1 | |
| C. | CH3COONH4溶液显中性,说明CH3COONH4中的离子均不发生水解 | |
| D. | 向pH和体积均相同的盐酸和醋酸中各加入少量相同质量的锌粉,后者反应速率最大 |
分析 A.电解精炼铜时,粗铜为阳极,失去电子;
B.由水电离的氢离子与氢氧根离子相等;
C.CH3COONH4溶液显中性,可知醋酸根离子与铵根离子的水解程度相同;
D.向pH和体积均相同的盐酸和醋酸,醋酸浓度大.
解答 解:A.电解精炼铜时,粗铜为阳极,失去电子,则粗铜与外接电源的正极相连,故A错误;
B.由水电离的氢离子与氢氧根离子相等,则纯水中c(H+)=c(OH-)=5×10-7mol•L-1,故B错误;
C.CH3COONH4溶液显中性,可知醋酸根离子与铵根离子的水解程度相同,醋酸与一水合氨的电离平衡常数相同,故C错误;
D.向pH和体积均相同的盐酸和醋酸,醋酸浓度大,则各加入少量相同质量的锌粉,后者反应速率最大,故D正确;
故选D.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、电解应用,为高频考点,把握弱酸的电离、pH与浓度的关系、盐类水解与弱电解质电离的关系为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,综合性较强,题目难度不大.

练习册系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
2.锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如图(部分条件未给出).
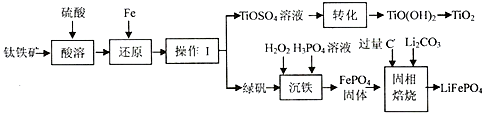
(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
则操作I 的名称为蒸发浓缩、冷却结晶、过滤.
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.

(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.
6.下列有机实验操作或叙述正确的是( )
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
16.短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的$\frac{2}{3}$,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价,下列说法正确的是( )
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
3.金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期,ⅢA族,化学性质与铝元素相似.
(1)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成,反应中,生成3mol H2时放出30.8KJ的热.
①反应的热化学方程式是2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H=-30.8KJ/mol.
②反应的化学平衡常数表达式是$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;温度升高时,反应的平衡常数变小.(填“变大”“变小”或“不变”)
③在密闭体系内进行上述可逆反应,下列有关表达正确的是A.

A.图象Ⅰ中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.图象Ⅱ中纵坐标可以为镓的转化率
C.图象Ⅲ中纵坐标可以为化学反应速率
D.图象Ⅳ中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是GaN+OH-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$GaO2-+NH3↑.
(2)将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(3)工业上电解精炼镓的原理如下:待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,高纯度镓为阴极,NaOH溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,离子迁移到达阴极并在阴极放出电析出高纯镓.
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是Fe、Cu.
②GaO2-在阴极放电的电极方程式是GaO2-+3e-+2H2O=Ga+4OH-.
(1)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成,反应中,生成3mol H2时放出30.8KJ的热.
①反应的热化学方程式是2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H=-30.8KJ/mol.
②反应的化学平衡常数表达式是$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;温度升高时,反应的平衡常数变小.(填“变大”“变小”或“不变”)
③在密闭体系内进行上述可逆反应,下列有关表达正确的是A.

A.图象Ⅰ中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.图象Ⅱ中纵坐标可以为镓的转化率
C.图象Ⅲ中纵坐标可以为化学反应速率
D.图象Ⅳ中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是GaN+OH-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$GaO2-+NH3↑.
(2)将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
(3)工业上电解精炼镓的原理如下:待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,高纯度镓为阴极,NaOH溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,离子迁移到达阴极并在阴极放出电析出高纯镓.
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是Fe、Cu.
②GaO2-在阴极放电的电极方程式是GaO2-+3e-+2H2O=Ga+4OH-.
20.在焊接铜器时,可用NH4Cl溶液除去铜器表面的氧化铜,其反应为CuO+NH4Cl-Cu+CuCl2+N2↑+H2O(未配平).下列有关该反应的说法正确的是( )
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
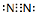 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.