题目内容
10.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
分析 A、水的电离是吸热反应,升高温度,氢离子浓度增大,pH减小;
B、一水合氨是弱碱,加入后溶液中的氢氧根浓度增大;
C、通入氯化氢后,溶液中离子浓度增大,导电能力增强;
D、硫酸氢钠是强电解质,溶于水电离出氢离子,溶液中氢离子浓度增大.
解答 解:A、△H>0,反应吸热,温度升高,平衡正向移动,溶液中氢离子浓度增大,pH降低,故A错误;
B、向水中加入稀氨水,一水合氨是弱电解质,电离的氢氧根使溶液中氢氧根浓度增大,平衡逆向移动,但是溶液中的氢氧根浓度升高,Kw不变,故B错误;
C、由于氢氧化钠是强电解质,加入后,溶液中的氢氧根离子浓度增大,平衡向逆向移动,但是溶液中的氢离子浓度减小;由于温度不变KW不变,故C正确;
D、由于HCl是强电解质,加入后,溶液中的氢离子浓度增大,平衡向逆向移动,但是溶液中的氢氧根离子浓度减小;由于温度不变KW不变,故D错误;
故选C.
点评 本题考查外界条件对弱电解质水的电离平衡的影响,注意加入酸、碱,平衡逆向移动,但是溶液中的氢离子或者氢氧根浓度反而增大,本题难度中等.

练习册系列答案
相关题目
20.高铁酸钠是一种新型、高效、多功能水处理剂,高铁酸钠(Na2FeO4)制备方法有:
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
1.电解质溶液的电导率越大,导电能力越强.用0.1mol•L-1的NaOH溶液分别滴定体积均为10.00mL浓度均为0.1mol•L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )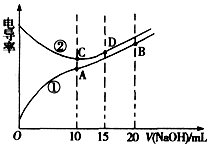

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
18.下列物质用途错误的是( )
| A. | 天然气用于民用燃料 | B. | 纯酒精用作医用消毒 | ||
| C. | 来苏水用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
15.下列各组离子反应可用H++OH-═H2O表示的是( )
| A. | 氢氧化钡和硫酸 | B. | 氢氧化钠和醋酸 | ||
| C. | 亚硝酸和氢氧化钾 | D. | 硫酸氢钾和氢氧化钠 |
2.在相同条件下,下面各组热化学方程式中,△H1>△H 2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
13.某工业废水中含有一定量的Cr2O72-和CrO42-,现取样该工业废水,检测其中铬的含量.
步骤I:取25.00mL废水,加入适量稀硫酸酸化.
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O然后滴入几滴指示剂.
步骤Ⅲ:用0.1000mol•L-1Na2S2O3溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6)滴定结果如下:
步骤Ⅳ:将上述反应后溶液进行调节PH,过滤等处理:沉淀回收,滤液倒入下水道.
回答下列问题
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)Cr2O72-水解的离子方程式Cr2O72-+H2O?2CrO42-+2H+ 步骤I加入稀硫酸酸化的目的是使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境
(3)在滴定时0.1000mol•L-1Na2S2O3溶液应盛放在碱式滴定管(填仪器名称),步骤Ⅱ中所加指示剂是淀粉溶液.
(4)步骤Ⅲ判断滴定达到终点的现象是溶液由蓝色变为无色,且在半分钟内不变色.
(5)以下操作会造成废水中Cr2O72-含量偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
(5)步骤Ⅳ在生产生活中的意义是防止重金属污染(任答一条).
步骤I:取25.00mL废水,加入适量稀硫酸酸化.
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O然后滴入几滴指示剂.
步骤Ⅲ:用0.1000mol•L-1Na2S2O3溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6)滴定结果如下:
| Na2S2O3起始读数 | Na2S2O3 终点读数 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
回答下列问题
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)Cr2O72-水解的离子方程式Cr2O72-+H2O?2CrO42-+2H+ 步骤I加入稀硫酸酸化的目的是使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境
(3)在滴定时0.1000mol•L-1Na2S2O3溶液应盛放在碱式滴定管(填仪器名称),步骤Ⅱ中所加指示剂是淀粉溶液.
(4)步骤Ⅲ判断滴定达到终点的现象是溶液由蓝色变为无色,且在半分钟内不变色.
(5)以下操作会造成废水中Cr2O72-含量偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
(5)步骤Ⅳ在生产生活中的意义是防止重金属污染(任答一条).
14.下列物质能用于制造光导纤维的是( )
| A. | 钢 | B. | 陶瓷 | C. | 玻璃 | D. | 二氧化硅 |