题目内容
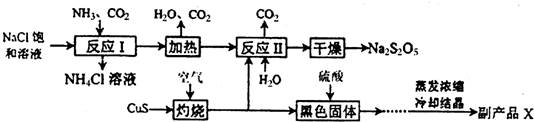
13.某工业废水中含有一定量的Cr2O72-和CrO42-,现取样该工业废水,检测其中铬的含量.步骤I:取25.00mL废水,加入适量稀硫酸酸化.
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O然后滴入几滴指示剂.
步骤Ⅲ:用0.1000mol•L-1Na2S2O3溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6)滴定结果如下:
| Na2S2O3起始读数 | Na2S2O3 终点读数 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
回答下列问题
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)Cr2O72-水解的离子方程式Cr2O72-+H2O?2CrO42-+2H+ 步骤I加入稀硫酸酸化的目的是使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境
(3)在滴定时0.1000mol•L-1Na2S2O3溶液应盛放在碱式滴定管(填仪器名称),步骤Ⅱ中所加指示剂是淀粉溶液.
(4)步骤Ⅲ判断滴定达到终点的现象是溶液由蓝色变为无色,且在半分钟内不变色.
(5)以下操作会造成废水中Cr2O72-含量偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
(5)步骤Ⅳ在生产生活中的意义是防止重金属污染(任答一条).
分析 根据实验目的,含有一定量的Cr2O72-和CrO42-工业废水,
步骤I:取25.00mL废水,加入适量稀硫酸酸化,由于使CrO42-在酸性条件下转化成Cr2O72-,所以加稀硫酸酸化是将使CrO42-尽可能的转化成Cr2O72-;
步骤Ⅱ:由于Cr2O72-具有氧化性,加入过量的碘化钾溶液,把Cr2O72-还原成三价铬,而碘离子被氧化成碘单质;
步骤Ⅲ:用0.1000mol•L-1 Na2S2O3溶液滴定生成的碘单质,通过消耗的Na2S2O3溶液量来计算碘单质的量,再根据碘单质的量回头计算Cr2O72-的量,从而达到实验目的.
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)根据以上分析,CrO42-在酸性条件下转化成Cr2O72-,据此书写Cr2O72-水解的离子方程式,判断加入稀硫酸酸化的目的;
(3)根据Na2S2O3溶液显碱性判断;根据滴定碘单质应选用淀粉作指示剂;
(4)根据滴定达到终点时碘单质刚好被消耗分析;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)根据Ⅳ将溶液中的三价铬以沉淀的形式除去,符合绿色化学的思想分析.
解答 解:(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色,故答案为:橙;黄;
(2)根据以上分析,CrO42-在酸性条件下转化成Cr2O72-,所以Cr2O72-水解的离子方程式为Cr2O72-+H2O?2CrO42-+2H+,则根据平衡移动原理,加入稀硫酸酸化的目的使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境,故答案为:Cr2O72-+H2O?2CrO42-+2H+;使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境;
(3)因为Na2S2O3溶液显碱性,所以Na2S2O3溶液应盛放在碱式滴定管;滴定碘单质应选用淀粉溶液作指示剂;故答案为:碱式滴定管;淀粉溶液;
(4)滴定达到终点时碘单质刚好被消耗,所以溶液的颜色由蓝色变为无色,且在半分钟内不变色,故答案为:溶液由蓝色变为无色,且在半分钟内不变色;
(5)根据Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O和I2+2Na2S2O3═2NaI+Na2S4O6,则c(待测)偏高,Cr2O72-含量就偏高;
A.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏低,故A错误;
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏高,故C正确;
D.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏高,故D正确;
故答案为:CD;
(6)Ⅳ的目的将溶液中的三价铬以沉淀的形式除去,因为铬离子使重金属离子,会污染河水,所以在排入河流之前一定要除去三价铬离子,故答案为:防止重金属污染.
点评 本题考查了工业废水中铬的质量分数的测定,涉及到滴定实验、误差分析等,难度适中,理解滴定的原理是解题关键.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
| A. | 放出碱液的滴定管开始有气泡,发出液体后气泡消失 | |
| B. | 滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 | |
| C. | 锥形瓶用蒸馏水洗涤后,直接加入待测溶液滴定 | |
| D. | 滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定 |
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.