题目内容
17.化学与生产、生活、社会密切相关.下列有关说法中不正确的是( )| A. | 在日常生活中,电化腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,但不可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
分析 A.在日常生活中,金属的腐蚀以电化学腐蚀为主;
B.依据盐类水解的应用解答;
C.二氧化硫具有漂白性,有毒;
D.纯碱是生产玻璃的原料之一,油脂在碱性条件下可发生水解反应.
解答 解:A.在日常生活中,金属的腐蚀以电化学腐蚀为主,电化学腐蚀是造成钢铁腐蚀的主要原因,故A正确;
B.明矾水解时产生具有吸附性的胶体粒子,可以用于除去水中固体杂质颗粒,用于净水,明矾不具有杀菌消毒作用,故B错误;
C.二氧化硫具有漂白性,有毒,所以可用于漂白纸浆,但不可以用于漂白食品,故C正确;
D.纯碱可用于生产普通玻璃,纯碱水解显碱性,能使油脂水解,故日常生活中也可用纯碱溶液来除去物品表面的油污,故D正确;
故选:B.
点评 本题是一道关于化学和应用方面知识的考查题,侧重考查元素化合物用途,熟悉相关物质的性质是解题关键,要求学生注意知识的梳理和归纳,灵活应用.

练习册系列答案
相关题目
6.下列各项说法正确的是( )
①氢氧化铁胶体中,H+、K+、S2-、Br-能大量共存
②向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
③沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
④明矾可用作净水剂
⑤向饱和FeCl3溶液中滴加氢氧化钠溶液,可制取Fe(OH)3胶体.
①氢氧化铁胶体中,H+、K+、S2-、Br-能大量共存
②向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
③沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
④明矾可用作净水剂
⑤向饱和FeCl3溶液中滴加氢氧化钠溶液,可制取Fe(OH)3胶体.
| A. | ①③④ | B. | ①②③④ | C. | ②④ | D. | ②③⑤ |
8.下列实验现象描述不正确的是
| 实验 | 现象 | |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球.燃烧时,火焰为黄色;燃烧后,生成淡黄色的固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔并不滴落,好像有一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 镁条在CO2中燃烧 | 剧烈燃烧,放出大量的热,产生耀眼白光,生成白色固体和黑色颗粒 |
| A. | A | B. | B | C. | C | D. | D |
2.化合物A是一种新型锅炉水除氧剂,其结构式如图所示,下列说法中正确的是( )
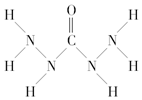

| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA | |
| D. | 常温常压下,1.6 g CH4含原子数为0.5NA |
7.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 打磨磁石制指南针 | ||
| C. | 黑火药的使用 | D. | 用铁矿石炼铁 |
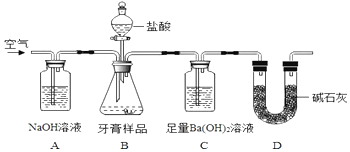 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究: