题目内容
15.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),有关下列图象的说法正确的是( )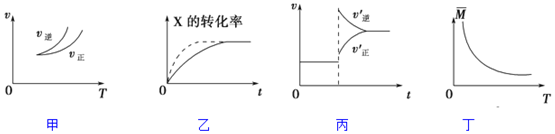
| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、压强增大,平衡正向移动;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A错误;
B、压强增大,平衡正向移动,缩短反应达到平衡的时间,X的转化率变大,故B错误;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应△H<0,故D错误;
故选C.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
3.下列关于钠的化合物的说法中,正确的是( )
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
10.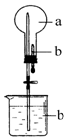 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | H2、O2混合气体与饱和食盐水 |
20.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、Br-、S2- | D. | NH4+、Al3+、Ac-、NO3- |
7.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 打磨磁石制指南针 | ||
| C. | 黑火药的使用 | D. | 用铁矿石炼铁 |
4.在元素周期表中,在金属元素和非金属元素分界线附近能找到( )
| A. | 制半导体材料的元素 | B. | 制催化剂的元素 | ||
| C. | 制农药的元素 | D. | 制耐高温合金的元素 |
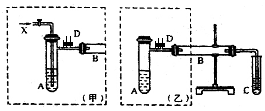 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答: