题目内容
2.下列叙述中正确的是( )| A. | 离子化合物中一定含有金属元素 | |
| B. | 分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 | |
| C. | 气态氢化物的稳定性:NH3>PH3>AsH3 | |
| D. | 正四面体结构的分子中的键角一定是109°28′ |
分析 A.铵盐是由非金属元素构成的离子化合物;
B.单原子分子中不存在共价键;
C.元素的非金属性越强,其氢化物越稳定;
D.正四面体结构的分子中的键角也可能是60°.
解答 解:A.铵盐是由非金属元素构成的离子化合物,所以离子化合物中不一定含有金属元素,故A错误;
B.单原子分子中不存在共价键,如稀有气体分子为单原子分子,分子中没有共价键,原子晶体中一定含有共价键,离子晶体一定含有离子键,故B错误;
C.元素的非金属性越强,其氢化物越稳定,非金属性:N>P>As,则气态氢化物的稳定性:NH3>PH3>AsH3,故C正确;
D.正四面体结构的分子中的键角也可能是60°,如白磷分子中键角是60°,不是109°28′,故D错误.
故选C.
点评 本题考查了化学键、离子化合物和共价化合物、氢化物稳定性比较、键角等,题目难度不大,侧重于基础知识的考查,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
表中V2=40mL,该实验的目的是实验目的是探究温度、亚硫酸钠溶液浓度与该反应速率的关系.
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
10.欲除去下列物质中的杂质(括号内为杂质),所选用的方法不妥当的是( )
| A. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸,然后加热 | |
| B. | 碳酸钠固体(碳酸氢钠):加热至恒重 | |
| C. | FeCl2溶液(FeCl3、CuCl2):加入过量Fe粉充分搅拌,然后过滤 | |
| D. | 乙醇(水):加入新制的生石灰,然后蒸馏 |
7. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
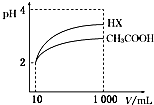
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
14.从人类利用金属的历史看,先是青铜器时代,后是铁器时代,而铝的利用只是近百年的事,造成这个先后顺序事实的最主要因素是( )
| A. | 金属的导电性 | B. | 金属的延展性 | ||
| C. | 地壳中金属元素的含量 | D. | 金属冶炼的难易程度 |
12.下列有机物分子中,属于正四面体构型的是( )
| A. | 乙烯 | B. | 乙炔 | C. | 苯 | D. | 四氯化碳 |
 .
.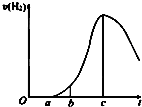 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.