题目内容
10.我国经济发展对能源的需求与日俱增.一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:X极:CH4+10OH--8e-═CO32-+7H2O Y极:4H2O+2O2+8e-═8OH-
(1)指出该电池的负极X(X或Y)极
(2)在标准状况下,通入11.2L甲烷气体,完全反应后有4mol电子转移;
(3)该电池的电解质溶液的PH变化是降低(填升高、降低、不变)
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,以此解答该题.
解答 解:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,
(1)由以上分析可知该电池的负极为通入甲烷的X极,故答案为:X;
(2)根据负极反应CH4+10OH--8e-=CO32-+7H2O,当通入11.2L甲烷气体即$\frac{11.2L}{22.4L/mol}$=0.5mol,所以完全反应后有0.5mol×8=4mol电子转移,故答案为:4;
(3)根据反应总反应为CH4+2OH-+2O2=CO32-+3H2O,消耗氢氧根离子,所以该电池的电解质溶液的PH降低,故答案为:降低.
点评 本题考查了燃料电池,为高频考点,明确得失电子与正负极的关系是解本题关键,能正确书写电池反应式并据此进行计算,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
20.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
18.下列分子中的各原子不可能在同一平面上的是( )
| A. | C2H4 | B. | CH3CH3 | C. | CH2═CHCl | D. | C2H2 |
15.LED系列产品是一类新型节能产品.图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图.下列叙述错误的是( )
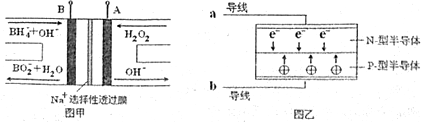

| A. | 电池A极区的电极反应式为:H2O2+2e-=2OH- | |
| B. | 电池放电过程中,Na+从负极区向正极区移动 | |
| C. | 每有1mol NaBH4参加反应转移电子数为4NA | |
| D. | 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连 |
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 40g金刚砂(SiC)中含有C-Si键的个数为2NA |
19.己知:Mn(s)+O2(g)═MnO2(s)△Hl
S(s)+O2(g)═SO2(g)△H2
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则下列表述正确的是( )
S(s)+O2(g)═SO2(g)△H2
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则下列表述正确的是( )
| A. | △H2>0 | |
| B. | △H3>△H1 | |
| C. | Mn+SO2═MnO2+S△H=△H2-△H1 | |
| D. | MnO2(s)+SO2(g)═MnSO4(s)△H═△H3-△H2-△H1 |
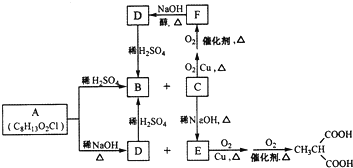
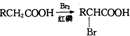 RCH2COOH$→_{红磷}^{Br_{2}}$
RCH2COOH$→_{红磷}^{Br_{2}}$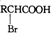 请以2一甲基丙醇和甲醇为原料,设计制备有
请以2一甲基丙醇和甲醇为原料,设计制备有