题目内容
1.常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )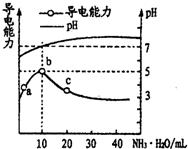
| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
分析 A.根据图知,0.1mol/L的HR溶液pH>1,说明HR部分电离;
B.酸或碱抑制水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,含有弱离子的盐促进水电离;
C.b点溶液的pH=7,则溶液中存在c(OH-)=c(H+),结合电荷守恒判断;
D.离子积常数只与温度有关,温度不变,离子积常数不变.
解答 解:A.根据图知,0.1mol/L的HR溶液pH>1,说明HR部分电离,则HR为弱酸,故A错误;
B.酸或碱抑制水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,含有弱离子的盐促进水电离,a溶液呈酸性、c溶液呈碱性,二者都抑制水电离,且两种溶液pH未知,无法判断抑制水电离程度大小,故B错误;
C.b点溶液的pH=7,则溶液中存在c(OH-)=c(H+),结合电荷守恒得c(NH4+)=c(R-),该点溶液中水电离程度很小,所以离子浓度大小顺序是c(NH4+)=c(R-)>c(OH-)=c(H+),故C错误;
D.离子积常数只与温度有关,温度不变,离子积常数不变,所以这几点溶液中离子积常数不变,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断及离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确曲线含义、对应溶液中溶质成分及其性质是解本题关键,注意:离子积常数只与温度有关,与其它因素都无关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16. 用图所示装置进行实验,能得出相应实验结论的是( )
用图所示装置进行实验,能得出相应实验结论的是( )
 用图所示装置进行实验,能得出相应实验结论的是( )
用图所示装置进行实验,能得出相应实验结论的是( )| 选项 | 实验试剂 | 实验结论 | ||
| A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
| B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
| C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
| D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
6.由铜、锌和稀硫酸组成的原电池工作时,下列说法正确的是( )
| A. | 电能转化为化学能 | B. | 铜片上产生大量的气泡 | ||
| C. | 原电池中锌是正极,发生氧化反应 | D. | 溶液的pH值减小 |
13.关于能量转化的叙述不正确的是( )
| A. | 反应物总能量高于生成物的总能量的反应为放热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 只有氧化还原反应中的化学能才有可能转化为电能---形成原电池 | |
| D. | 需要加热才能发生的反应都是吸热反应 |
 .
.
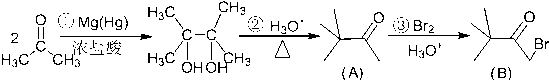
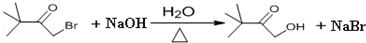 .
.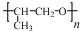 ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: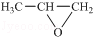 .
.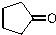 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: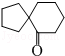 .
.