题目内容
13.关于能量转化的叙述不正确的是( )| A. | 反应物总能量高于生成物的总能量的反应为放热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 只有氧化还原反应中的化学能才有可能转化为电能---形成原电池 | |
| D. | 需要加热才能发生的反应都是吸热反应 |
分析 化学反应的实质为化学键的断裂和形成,断裂化学键吸收能量,形成化学键放出能量,从宏观的角度来说,反应物总能量高于生成物的总能量的反应为放热反应,反之为吸热反应,反应是否吸热与反应的条件无关,以此解答该题.
解答 解:A.从能量守恒的角度判断,反应物总能量高于生成物的总能量的反应为放热反应,反之为吸热反应,故A正确;
B.化学反应的实质为化学键的断裂和形成,断裂化学键吸收能量,形成化学键放出能量,则化学键的断裂和形成是化学反应中能量变化的主要原因,故B正确;
C.原电池为化学能转化为电能的装置,涉及的反应必须为氧化还原反应,故C正确;
D.需要加热才能发生的反应不一定为吸热反应,也可能为放热反应,如铝热反应等,故D错误.
故选D.
点评 本题综合考查化学反应中的能量变化,为高频考点,侧重于学生的分析能力以及双基的考查,题目涉及放热反应和吸热反应的判断等,难度不大.正确理解放热、吸热的本质是解题的关键.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
1.常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )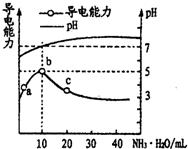

| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
18.下列关于药物的叙述中,错误的是( )
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
5.利用下列实验装置能完成相应实验的是( )
| A. | 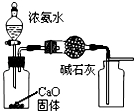 制取并收集干燥纯净的NH3 | |
| B. | 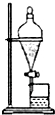 用该装置分离乙酸乙酯和饱和碳酸钠溶液 | |
| C. | 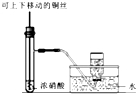 用于制备并收集少量NO2 | |
| D. | 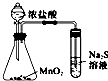 比较MnO2、Cl2、S的氧化性 |
2.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙) ( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙) ( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
3.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的 ( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
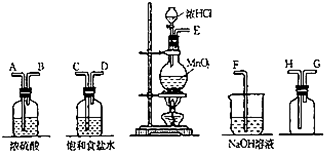 实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: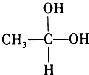 →CH3-CHO+H2O
→CH3-CHO+H2O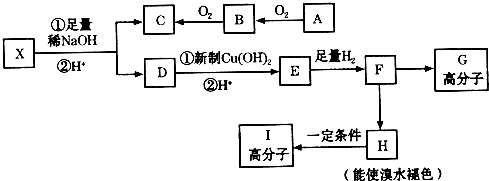
 .
. .
. .
.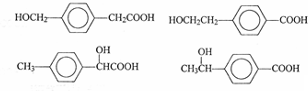 任意一种.
任意一种.