题目内容
14.氧元素有多种核素,其中核素188O的中子数是( )| A. | 8 | B. | 10 | C. | 18 | D. | 26 |
分析 核素188O的质子数为8,质量数为18,中子数=质量数-质子数,以此来解答.
解答 解:核素188O的质子数为8,质量数为18,中子数=18-8=10,故选B.
点评 本题考查原子中的数量关系,为高频考点,把握核素中不同位置数字的意义、原子中的数量关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.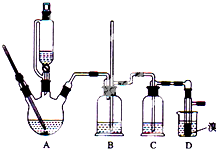 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是凝固点较低,过度冷却会使其凝固而使气路堵塞.
 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是凝固点较低,过度冷却会使其凝固而使气路堵塞.
5.下列说法中正确的是( )
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |
2.已知:相同温度下Ka(HF)>Ka(HCN).现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是( )
| A. | 溶液pH:NaF>NaCN | B. | n1>n2 | ||
| C. | H2O的电离程度:NaF>NaCN | D. | c(F-)<c(CN-) |
9.下列叙述不正确的是( )
| A. | 异戊二烯分子里的所有原子不可能在同一平面上 | |
| B. | 浓氨水洗涤做过银镜反应的试管 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物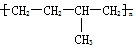 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
19.下列实验方法正确的是( )
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
6.下列叙述正确的是( )
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
3.现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 过滤 萃取 分液 | B. | 萃取 分液 蒸馏 | C. | 分液 蒸馏 萃取 | D. | 萃取 蒸馏 分液 |
5. 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{15.95+15.00+15.05+14.95}{4}$mL=15.24mL.指出他的计算的不合理之处第一次误差明显大,属异常值,应舍去.按正确数据处理,可得c(市售白醋)=0.45mol•L-1;市售白醋总酸量=0.075g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{15.95+15.00+15.05+14.95}{4}$mL=15.24mL.指出他的计算的不合理之处第一次误差明显大,属异常值,应舍去.按正确数据处理,可得c(市售白醋)=0.45mol•L-1;市售白醋总酸量=0.075g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.