题目内容
20. 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.(1)水制取H2的常见原料,下列有关水的说法正确的是b
a.水分子是一种极性分子,水分子空间结构呈直线型
b.H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H-O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键.
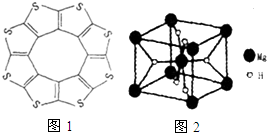
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为sp2,C16S8中碳硫键键长介于C-S与C=S之间,原因可能是分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,C16S8与H2微粒间的作用力是范德华力
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(.用“→”表示)的氨硼烷的结构式
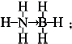 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).③一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构相似,该晶体储氢后的化学式为Cu3AuH8.
④MgH2是金属氢化物储氢材料,其晶胞如图2所示,已知该晶体的密度ag?cm-3,则晶胞的体积为$\frac{52}{a•{N}_{A}}$cm3〔用含a,、NA的代数式表示,NA表示阿伏伽德罗常数〕.
分析 (1)a.H2O中H、O元素形成的极性键,分子空间结构呈V型,正负电荷中心不重合,属于极性分子;
b.H2O分子中2个氢原子的2个由s轨道与氧原子的sp3杂化轨道形成σ键;
c.水分子之间是通过氢键作用形成冰晶体;
d.冰晶胞: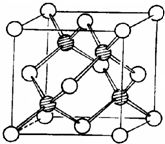 ,干冰晶胞:
,干冰晶胞: ;
;
(2)①对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断,当n=2,sp杂化,n=3,sp2杂化,n=4,sp3杂化;分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;分子与分子间的作用力为分子间作用力;
②根据氮原子提供一对共用电子对给硼原子形成配位键;根据等电子体具有相同的电子数目和原子数目来分析;
③CaF2的结构如图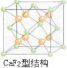 ,利用均摊法计算;
,利用均摊法计算;
④先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=$\frac{m}{ρ}$计算其体积.
解答 解:(1)a.H2O分子空间结构呈V型,正负电荷中心不重合,属于极性分子,故a错误;
b.H2O分子中2个氢原子的2个由s轨道与氧原子的sp3杂化轨道形成σ键,故b正确;
c.水形成冰晶体是通过氢键作用的,不是H-O键,故c错误;
d.冰晶胞: ,干冰晶胞:
,干冰晶胞: ,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;
,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;
故答案为:b;
(2)①根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式;
分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,可导致C16S8中碳硫键键长介于C-S与C=S之间;
分子之间存在范德华力,C16S8与H2微粒间的作用力是范德华力,
故答案为:sp2;分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;范德华力;
②氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷的结构式为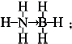 ,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
故答案为: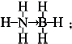 ;CH3CH3;
;CH3CH3;
③CaF2的结构如图 ,根据题意知,该晶胞中铜原子个数=6×$\frac{1}{2}$=3,金原子个数=8×$\frac{1}{8}$=1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
,根据题意知,该晶胞中铜原子个数=6×$\frac{1}{2}$=3,金原子个数=8×$\frac{1}{8}$=1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:Cu3AuH8;
④该晶胞中镁原子个数=$\frac{1}{8}$×8+1=2,氢原子个数=4×$\frac{1}{2}$+2=4,V=$\frac{m}{ρ}$=$\frac{\frac{M}{{N}_{A}}(24×2+1×4)}{ρ}$cm3=$\frac{52}{a•{N}_{A}}$ cm3,
故答案为:$\frac{52}{a•{N}_{A}}$.
点评 本题考查物质结构和性质,涉及杂化方式的判断、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 含有-OH的有机化合物性质相同 | |
| B. | 锅炉水垢中的CaSO4可用饱和Na2CO3溶液处理,使之转化为CaCO3后再用盐酸除去 | |
| C. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有单质参加,又有单质生成的反应一定是氧化还原反应 |
| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
| A. | 金属氧化物一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| B. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| C. | 金属阳离子被还原一定得到相应的金属单质 | |
| D. | 在氧化还原反应中金属单质只能作还原剂 |
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
 ;
; 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.