题目内容
5.下列说法正确的是( )| A. | 金属氧化物一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| B. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| C. | 金属阳离子被还原一定得到相应的金属单质 | |
| D. | 在氧化还原反应中金属单质只能作还原剂 |
分析 A.金属氧化物可能为两性氧化物,非金属氧化物不一定能与碱反应;
B.同素异形体之间的转化为非氧化还原反应;
C.如金属具有多种化合价,被还原不一定生成单质;
D.金属单质的化合价为最低价,只具有还原性.
解答 解:A.金属氧化物可能为两性氧化物,如氧化铝,非金属氧化物不一定能与碱反应,如CO等,故A错误;
B.有单质参加或有单质生成的反应不一定是氧化还原反应,如:石墨转化为金刚石就不是氧化还原反应,故B错误;
C.如金属具有多种化合价,被还原不一定生成单质,如铁离子被还原可生成亚铁离子,故C错误;
D.金属单质的化合价为最低价,只具有还原性,在氧化还原反应中金属单质只能作还原剂,故D正确.
故选D.
点评 本题考查氧化还原反应,明确反应中是否存在元素的化合价变化是解答的关键,并注意利用实例来说明选项的正误.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
15.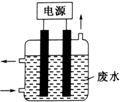 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
16.日常饮用水中NO3-的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人体健康产生危害.为了降低饮水中NO3-的浓度,某自来水厂设计了如下方案:
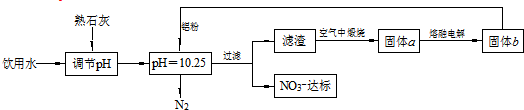
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无害 | |
| D. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 |
13.下列溶液中微粒浓度关系一定正确的是( )
| A. | 0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| D. | 同浓度的三种溶液:①CH3COONH4 ②NH4Cl ③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
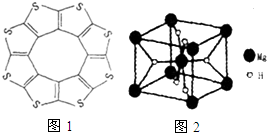 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.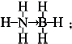 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
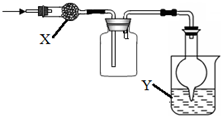 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )