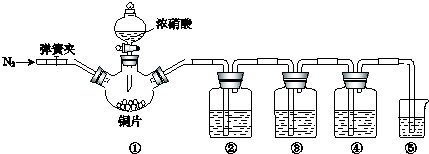
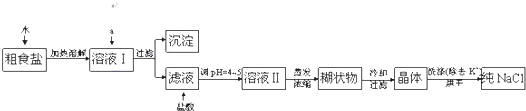
题目内容
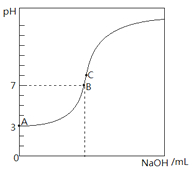 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:A、根据在滴定开始时的pH来判断和计算;
B、根据溶液中的电荷守恒来判断;
C、当NaOH溶液的体积为10.00mL时,是NaA与HA物质的量之比1:1的混合物,若HA电离程度大于A-的水解程度,则c(Na+)>c(HA),若HA电离程度小于A-的水解程度,则c(Na+)<c(HA),由电荷守恒可知:
(A-)+c(OH-)=c(Na+)+c(H+),所以c(A-)+c(OH-)≠c(HA)+c(H+);
D、C点溶液呈碱性,c(H+)<c(OH-),由电荷守恒确定.
B、根据溶液中的电荷守恒来判断;
C、当NaOH溶液的体积为10.00mL时,是NaA与HA物质的量之比1:1的混合物,若HA电离程度大于A-的水解程度,则c(Na+)>c(HA),若HA电离程度小于A-的水解程度,则c(Na+)<c(HA),由电荷守恒可知:
(A-)+c(OH-)=c(Na+)+c(H+),所以c(A-)+c(OH-)≠c(HA)+c(H+);
D、C点溶液呈碱性,c(H+)<c(OH-),由电荷守恒确定.
解答:
解:A、滴定开始时0.1000mol/L酸中氢离子浓度为0.001mol/L,故该酸为弱酸,Ka=
=
=10-5,故A正确;
B、达到B、E状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、当NaOH溶液的体积为10.00mL时,是NaA与HA物质的量之比1:1的混合物,若HA电离程度大于A-的水解程度,则c(Na+)>c(HA),若HA电离程度小于A-的水解程度,则c(Na+)<c(HA),由电荷守恒可知(A-)+c(OH-)=c(Na+)+c(H+),所以c(A-)+c(OH-)≠c(HA)+c(H+),故C错误;
D、C点溶液呈碱性,c(H+)<c(OH-),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(Na+)>c(A-),故D正确.
故选C.
| c(H+)c(A-) |
| c(HA) |
| 10-3×10-3 |
| 0.1 |
B、达到B、E状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、当NaOH溶液的体积为10.00mL时,是NaA与HA物质的量之比1:1的混合物,若HA电离程度大于A-的水解程度,则c(Na+)>c(HA),若HA电离程度小于A-的水解程度,则c(Na+)<c(HA),由电荷守恒可知(A-)+c(OH-)=c(Na+)+c(H+),所以c(A-)+c(OH-)≠c(HA)+c(H+),故C错误;
D、C点溶液呈碱性,c(H+)<c(OH-),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(Na+)>c(A-),故D正确.
故选C.
点评:本题考查中和滴定,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
某固体混合物可能含有NH4Cl、NaOH、KOH、AgNO3、A1C13中的若干种,加适量水充分搅拌,得到无色澄清溶液A,取A进行如下实验:根据上述实验现象,以下推测正确的是( )
①蘸取A灼烧,未见火焰出现黄色;
②取A逐滴加入稀硝酸至过量,不断生成白色沉淀后沉淀部分溶解;
③取1mLA加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”.
①蘸取A灼烧,未见火焰出现黄色;
②取A逐滴加入稀硝酸至过量,不断生成白色沉淀后沉淀部分溶解;
③取1mLA加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”.
| A、A中存在A1O2- |
| B、A中c(C1-)>c(K+) |
| C、A的pH>7 |
| D、固体由NH4Cl、KOH、AgNO3 组成 |
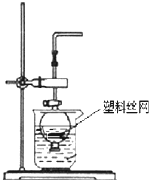 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |