题目内容
一种镀锡铜线表面锡的褪除及回收的工艺流程如图所示,回答以下问题.
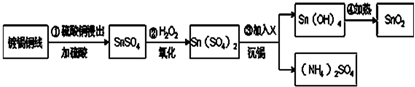
(1)步骤①中加入硫酸的目的是 ,由下表数据分析可得最佳浸出温度为 .
(2)步骤②中,发生反应的离子方程式为 .
(3)步骤③中,X为 .25℃时为使Sn 4+沉淀完全[c(Sn 4+)<1.0×10-5 mol?L-1],应调节pH值最小为 .(已知25℃时,Ksp[Sn(OH)4]=1.0×10-45)

(1)步骤①中加入硫酸的目的是

(2)步骤②中,发生反应的离子方程式为
(3)步骤③中,X为
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:锡比铜活泼,将镀锡铜线用硫酸铜溶液浸出,可生成硫酸锡,在酸性条件下加入过氧化氢,可生成Sn(SO4)2,加入X生成Sn(OH)4和硫酸铵,可知加入的X为NH3?H20 或NH3,结合溶度积常数解答该题.
解答:
解:(1)将镀锡铜线用硫酸铜溶液浸出,可生成硫酸锡,为防止Sn2水解,可加入硫酸酸化,由表中数据可知,当温度达到60℃时,Sn的浸出率已达98.6%,再继续升高温度,变化不大,则最佳温度为60℃,
故答案为:抑制Sn2+水解;60℃;
(2)硫酸锡在酸性条件下被过氧化氢氧化生成Sn(SO4)2,反应的离子方程式为Sn2++2H++H202=Sn4++2H20,
故答案为:Sn2++2H++H202=Sn4++2H20;
(3),加入X生成Sn(OH)4和硫酸铵,可知加入的X为NH3?H20 或NH3,25℃时为使Sn 4+沉淀完全[c(Sn 4+)<1.0×10-5 mol?L-1],应满足c(Sn4+)×c4(OH-)>1.0×10-45,c(OH-)>
mol/L=1.0×10-10mol/L,所以溶液的pH应大于4,
故答案为:NH3?H20 或NH3;4.
故答案为:抑制Sn2+水解;60℃;
(2)硫酸锡在酸性条件下被过氧化氢氧化生成Sn(SO4)2,反应的离子方程式为Sn2++2H++H202=Sn4++2H20,
故答案为:Sn2++2H++H202=Sn4++2H20;
(3),加入X生成Sn(OH)4和硫酸铵,可知加入的X为NH3?H20 或NH3,25℃时为使Sn 4+沉淀完全[c(Sn 4+)<1.0×10-5 mol?L-1],应满足c(Sn4+)×c4(OH-)>1.0×10-45,c(OH-)>
| 4 |
| ||
故答案为:NH3?H20 或NH3;4.
点评:本题考查物质的分离提纯的综合应用,为高频考点,侧重于学生的分析、实验和计算能力的考查,主要把握实验的原理以及相关物质的性质,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定性依次减弱 |
| B、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| C、F2、Cl2、Br2、I2的熔沸点逐渐升高 |
| D、H2S的熔沸点小于H2O的熔沸点 |
下列反应中,水既不是氧化剂,又不是还原剂的是( )
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2F2+2H2O=4HF+O2 |
| C、NaH+H2O=NaOH+H2↑( NaH中H为-1价) |
| D、Cl2+H2O=HCl+HClO |
X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍;Y最高价与最低价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2.下列说法不正确的是( )
| A、存放W单质的仓库失火不能用CO2灭火 |
| B、Z的氧化物通常形成分子晶体 |
| C、Y的单质能把溴从溴化物中置换出来 |
| D、X的氢化物可以是两种液体 |

 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)