题目内容
19.下列说法中正确的是( )| A. | SO2、CO2、SiO2中的S、C、Si均为sp3杂化 | |
| B. | SO32-、CO32-、SiO32-均为平面三角形 | |
| C. | H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 | |
| D. | 石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键 |
分析 A.根据中心原子的价层电子对数判断;
B.先判断杂化类型,再判断微粒构型;
C.在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键;
D.金属单质中含有金属键.
解答 解:A.CO2、SiO2中的C、Si的价层电子对数为4,均为sp3杂化,SO2中S原子的价层电子对数为2+$\frac{1}{2}$(6-2×2)=3,为sp2杂化,故A错误;
B.SO32-中S原子的价层电子对数为3+$\frac{1}{2}$(6+2-2×3)=4,含有一个孤电子对,属于三角锥形,CO32-中C原子的价层电子对数为3+$\frac{1}{2}$(4+2-2×3)=3,没有孤电子对,为平面三角形,SiO32-为平面三角形,故B错误;
C.在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,所以H3O+、NH4+、[Cu(NH3)4]2+均含有配位键,故C正确;
D.金属单质中含有金属键,石墨、新型高分子导电材料聚乙炔中含有共价键,没有金属键,故D错误.
故选C.
点评 本题考查了杂化类型的判断和微粒构型的判断、化学键、配位键,题目难度不大,注意把握价层电子对互斥理论及其应用,侧重于考查学生对基本理论的应用能力.

练习册系列答案
相关题目
10.下列微粒中:
①13Al3+ ②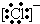 ③
③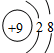 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )
①13Al3+ ②
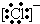 ③
③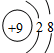 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )| A. | ①③ | B. | ②③④ | C. | ②④ | D. | ①③④ |
14.下列能用键能大小解释的是( )
| A. | 液态水的密度大于冰的密度 | B. | 碘单质和干冰容易升华 | ||
| C. | 氧气的氧化性不如氯气的氧化性 | D. | 溴容易溶于四氯化碳 |
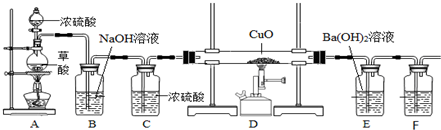
11.下列实验方案能达到目的( )
| A. | 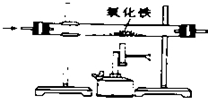 除去CO中的CO2 除去CO中的CO2 | B. | 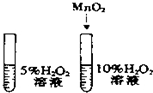 探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. | 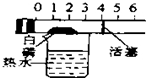 探究空气中氧气的含量 探究空气中氧气的含量 | D. | 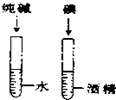 探究溶解性的影响因素 探究溶解性的影响因素 |
8.下列说法正确的是( )
| A. | 苯酚不慎沾到皮肤上,要先用氢氧化钠溶液清洗,再用水洗 | |
| B. | 被蜜蜂或者蚂蚁蛰了以后痛痒难忍,可以用稀硼酸溶液清洗被蛰处,可减轻痛痒 | |
| C. | 浓硝酸不慎滴到皮肤上,皮肤变成黄色,是因为发生了颜色反应 | |
| D. | 甘油和乙二醇都可以用做抗冻剂,是因为这两个物质的凝固点比较低 |
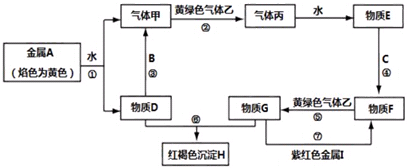
9.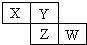 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |