题目内容
11.下列实验方案能达到目的( )| A. | 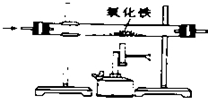 除去CO中的CO2 除去CO中的CO2 | B. | 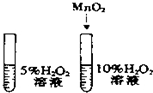 探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. | 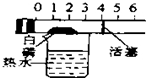 探究空气中氧气的含量 探究空气中氧气的含量 | D. | 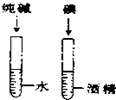 探究溶解性的影响因素 探究溶解性的影响因素 |
分析 A.CO与氧化铁反应生成铁和二氧化碳,会把原物质除去;
B.探究二氧化锰对反应速率的影响,需要控制过氧化氢溶液的浓度相同;
C.白磷燃烧产生固体,根据气体变化的体积差可以计算氧气的含量;
D.溶质不同来验证溶质的影响,不能达到目的.
解答 解:A.一氧化碳与氧化铁反应生成铁和二氧化碳,反而会把原物质除去,不符合除杂原则,故A错误;
B.探究二氧化锰对反应速率的影响时,需要控制过氧化氢溶液的浓度相同,然后一个加入二氧化锰,一个不加二氧化锰,图中过氧化氢溶液的浓度不同,故B错误;
C.白磷燃烧产生固体,使注射器内的气压变小,根据气体变化的体积差可以计算氧气的含量,故C正确;
D.探究溶解性的影响因素时,两支试管内都应放碘,一支试管内放水,一支试管内放酒精,看溶剂的影响;或通过放入溶剂相同,溶质不同来验证溶质的影响,不能达到目的,故D错误;
故选C.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确常见实验装置及其应用方法为解答关键,注意掌握常见实验原理及操作方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
2.下列说法正确的是( )
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
19.下列说法中正确的是( )
| A. | SO2、CO2、SiO2中的S、C、Si均为sp3杂化 | |
| B. | SO32-、CO32-、SiO32-均为平面三角形 | |
| C. | H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 | |
| D. | 石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键 |
16.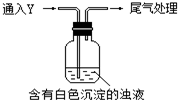 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如表:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Ag2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于过量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓NHO3,产生红棕色气体
Ⅲ.用Ba(HO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X具有还原性;X中含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是:Ag2SO3+H2O=2Ag+H2SO4.
 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如表:
| 实验 | pH | 实 验 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Ag2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于过量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓NHO3,产生红棕色气体
Ⅲ.用Ba(HO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X具有还原性;X中含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是:Ag2SO3+H2O=2Ag+H2SO4.
3.已知25℃时下列酸的电离平衡常数:K(CH3COOH)=1.75×10-5、K(HCN)=6.2×10-10、K1(H2CO3)=4.2×10-7、K2(H2CO3)=5.6×10-11下列选项不正确的是( )
| A. | 过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 | |
| B. | 经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10-5 | |
| C. | 将等物质的量浓度的CH3COONa与NaCN溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) | |
| D. | 常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<4 |
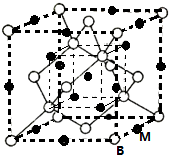 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):