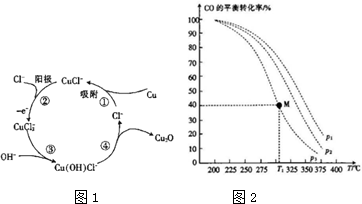
题目内容
10.“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是( )| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
分析 绿色化学的要求:一是反应物全部转化为期望的产物,使原子的利用率达到100%,可知化合反应、加成反应符合绿色化学的要求,二是不产生污染物,据此解答.
解答 解:A.制氯乙烷是加成反应,产物唯一,原子利率100%,符合绿色化学理念,故A不选;
B.制甲基丙烯酸甲酯是加成反应,产物唯一,原子利率100%,符合绿色化学理念,故B不选;
C.制CuSO4的反应中虽没有污染物生成,但有水生成,原子利用率不到100%,不符合绿色化学理念,故C可选;
D.制Cu(NO3)2的反应中有有毒气体放出,会导致环境污染,不符合倡导的绿色化学,故D可选;
故选CD.
点评 本题考查了“绿色化学”的含义,解答本题的关键是要读懂题目要求,准确理解绿色化学的含义,绿色化学的要求是原子利用率是100%且不产生污染物,题目比较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.CO2 分子中σ键与π键数目比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 1:3 |
16.下列物质能发生消去反应且产物只有一种的是( )
| A. | (CH3)3COH | B. | CH3OH | C. | CH3CHICH2CH3 | D. | (CH3)3C-CH2Cl |
13.已知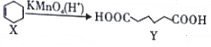 ,下列说法错误的是( )
,下列说法错误的是( )
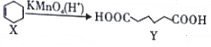 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X分子中所有碳原子一定在同一平面上 | |
| B. | X与乙烯不属于同系物 | |
| C. | Y可发生取代反应、氧化反应 | |
| D. | Y的含有相同官能团的同分异构体有8种(不考虑立体异构) |
15.下列电极反应式与出现的环境相匹配的是( )
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
19. 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=0.10mol•Lˉ1•minˉ1.
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
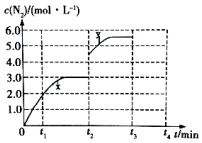
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.
 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.