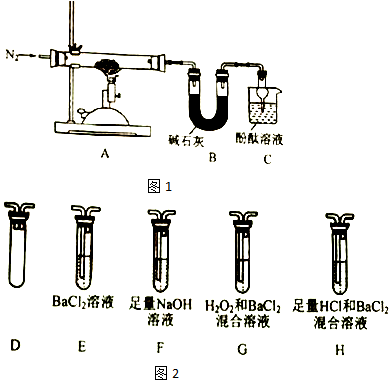
题目内容
15.CO2 分子中σ键与π键数目比为( )| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 1:3 |
分析 CO2 分子结构式为O=C=O,双键一个σ键,一个是π键,所以分子中含有2个σ键、2个π键,以此解答.
解答 解:CO2 分子结构式为O=C=O,双键一个σ键,一个是π键,所以分子中含有2个σ键、2个π键,则σ键与π键数目比为1:1,
故选C.
点评 本题考查共价键的形成和分类,为高频考点,侧重于基本概念的综合理解和运用的考查,注意把握共价键的形成和分类为解答该题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.碳酸亚铁(FeCO3)是一种重要的工业盐.某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
①生成FeCO3离子方程式:Fe2++CO32-=FeCO3↓.
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因NaHCO3中存在电离平衡:HCO3-?H++CO32-,加FeSO4,Fe2++CO32-=FeCO3↓;平衡右移,H++HCO3-=CO2↑+H2O.
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
实验改进的意图是反应放出CO2,给反应创设无O2的环境.
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
| 实 验 Ⅰ | 操作 | 现象 |
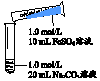 | 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
| 实验Ⅱ | 操作 | 现象 |
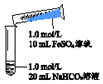 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
| 实验Ⅱ | 操作 | 现象 |
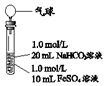 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
6.用括号内的试剂或分离方法,除去下列各物质中少量的杂质或分离出物质,正确的是( )
| A. | 苯中的溴(碘化钾溶液) | B. | 汽油中的苯(水) | ||
| C. | 煤焦油中的苯、甲苯、二甲苯(分液) | D. | 甲烷中的乙烯(溴水) |
3.下列反应的离子方程式书写正确的是( )
| A. | 氯化钠与浓硫酸混合加热:H2SO4(浓)+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO${\;}_{4}^{2-}$+2HCl↑ | |
| B. | 过量的硫化钠溶液与氯化铁溶液反应:2Fe3++S2-═2Fe2++S↓ | |
| C. | 碳酸氢铵溶液与足量NaOH溶液混合后加热:NH${\;}_{4}^{+}$+HCO${\;}_{3}^{-}$+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO${\;}_{3}^{2-}$+NH3↑+2H2O | |
| D. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
20.目前,我市电能的主要来源是火力发电. 下列关于火力发电过程中能量转化关系的描述,正确的是( )

| A. | 化学能转化成机械能在转化成电能 | |
| B. | 化学能转化成热能在转化成电能 | |
| C. | 化学能转化成机械能在转化成热能在到机械能 | |
| D. | 化学能转化成热能在转化成机械能在到电能 |
7.下列各组递变情况描述错误的是( )
| A. | H、Be、B 原子最外层电子数依次增多 | |
| B. | P、S、Cl 元素最高正化合价依次升高 | |
| C. | F2、Cl2、Br2、I2的熔点依次降低 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
4.对于下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 | |
| B. | Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘 |
10.“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是( )
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |