题目内容
20.常温下,下列各环境下的离子组合能大量共存的是( )| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
分析 A.Mg2+、Fe3+水解溶液呈酸性;
B.水电离的c(H+)=1×10-10mol•L-1的溶液为酸性或者碱性溶液;
C.c(H+)=10-14 mol•L-1 的溶液呈碱性;
D.pH试纸变红的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子、铁离子能够氧化碘离子、次氯酸根离子能够氧化碘离子.
解答 解:A.Mg2+、Fe3+、为弱碱的阳离子水解呈酸性,所以中性溶液中不可能存在Mg2+、Fe3+、SO42-、Cl-,故A错误;
B.水电离的c(H+)=1×10-10mol•L-1的溶液为 酸性或者碱性溶液,Al3+、NH4+、能够与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.c(H+)=10-14 mol•L-1 溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故C正确;
D.pH试纸变红的溶液中存在大量氢离子,硝酸根离子在酸性条件下具有强氧化性,Fe3+、NO3-、ClO-能够氧化I-,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查溶液酸碱性、复分解反应和及氧化还原反应,题目难度中等.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
15.图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )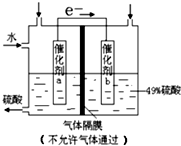

| A. | 该装置将化学能转化为电能,电流方向为b→a | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |
12.NA为阿伏伽德罗常数的值.下列说法不正确的是( )
| A. | 10gH218O与10gD2O所含的中子数均为5NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液所含NH4+数为0.1NA | |
| C. | 2.4gMg在空气中充分燃烧,转移电子数为0.2NA | |
| D. | 100g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
10.科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
| A. | 提出了元素周期律 | B. | 开发了合成氨的生产工艺 | ||
| C. | 揭示了燃烧的本质 | D. | 提取了治疟药物青蒿素 |
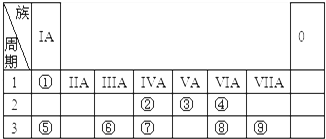
 ;
;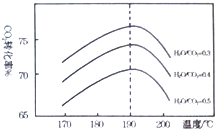 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3