题目内容
5.常温下,某溶液中由水电离产生的c(OH-)=10-10mol/L,则该溶液的pH=4或10.分析 常温下,某溶液中由水电离产生的c(OH-)=1×10-10mol/L,常温下纯水中水电离的氢离子浓度为c(OH-)=1×10-7mol/L,说明该溶液中抑制了水的电离,该溶液可能为酸溶液或者碱溶液,若为酸溶液,结合水的离子积计算溶液中氢离子浓度,若为碱的溶液,溶液中氢离子浓度为c(H+)=1×10-10mol/L,再根据pH=-lgc(H+)计算.
解答 解:水电离的c(OH-)=1×10-10mol/L<1×10-7mol/L,说明该溶液抑制了水的电离,溶液可能为酸溶液或碱溶液,
若为酸溶液,水电离产生的c(OH-)=1×10-10mol/L,则溶液中氢离子浓度为c(H+)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=1×10-4mol/L,溶液的pH=4;
若为碱溶液,则溶液中的氢离子是水电离的,则溶液中氢离子浓度为c(H+)=1×10-10mol/L,溶液的pH=10,
故答案为:4或10.
点评 本题考查溶液pH的简单计算,明确酸溶液或碱溶液对水的电离的影响是解题关键,注意掌握溶液酸碱性与溶液pH的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.常温常压下,下列各组气体能共存的是( )
| A. | SO2与O2 | B. | NO与O2 | C. | H2S与NO2 | D. | NH3和HCl |
13.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的非金属性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W、Z形成的某化合物常可用作萃取剂 | |
| D. | WY2分子中既有非极性键又有极性键 |
20.常温下,下列各环境下的离子组合能大量共存的是( )
| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
10.pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示:
已知草酸的电离常数K${\;}_{{a}_{1}}$=5.6×10-2,K${\;}_{{a}_{2}}$=5.4×10-5
下列叙述正确的是( )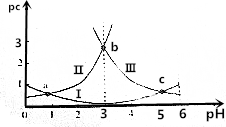
已知草酸的电离常数K${\;}_{{a}_{1}}$=5.6×10-2,K${\;}_{{a}_{2}}$=5.4×10-5
下列叙述正确的是( )

| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
15.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素教案的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )
| A. | 第ⅠA族的元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即18个族 | |
| C. | 短周期是第一、二、三、四周期 | |
| D. | 元素周期表有七个横行,也是七个周期 |
 下列实验设计或操作合理的是BGH
下列实验设计或操作合理的是BGH
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.