题目内容
15.图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )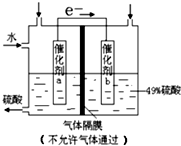
| A. | 该装置将化学能转化为电能,电流方向为b→a | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |
分析 A.该装置没有外加电源,是一个原电池,电流方向与电子流向相反;
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱;
C.催化剂a表面是SO2失去电子生成硫酸;
D.总方程为:SO2+H2O+$\frac{1}{2}$O2 =H2SO4,先设加入的SO2的量和加入的水的量,再根据方程求出生成硫酸的量和消耗的水的量.
解答 解:A.该装置没有外加电源,是一个原电池,把化学能转化为电能,电流方向与电子流向相反,所以电流方向为b→a,故A正确;
B.由图示可看出,电子由a表面转移到b表面,因此a表面发生氧化反应,由题意SO2转化为H2SO4发生氧化反应,因此催化剂a表面SO2发生氧化反应,催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程式为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:$\frac{1}{2}$O2+2H++2e-=H2O
总方程为:SO2+H2O+$\frac{1}{2}$O2=H2SO4
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:$\frac{xg×98g/mol}{64g/mol}$
水的质量变化为:y-$\frac{xg×98g/mol}{64g/mol}$
根据二者的比值为49%,可以求得$\frac{x}{y}$=$\frac{8}{15}$,故D正确;
故选B.
点评 本题以二氧化硫制硫酸为知识背景,考查了原电池的原理和电极方程式的书写.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
5.下列物质中,互为同分异构体的是( )
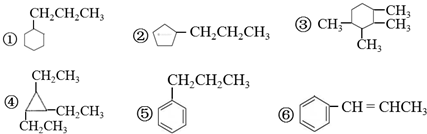

| A. | ①② | B. | ⑤⑥ | C. | ①④ | D. | ③④ |
6.下列关于浓硝酸和浓硫酸说法不正确的是( )
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 常温下,浓硝酸和浓硫酸不和铁、铝反应 |
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
20.常温下,下列各环境下的离子组合能大量共存的是( )
| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
7.下图为海洋资源综合开发利用流程,有关说法中正确的是( 

| A. | 从海水中提取D2O是化学变化 | |
| B. | 从海带中提取I2时可用乙醇进行萃取 | |
| C. | 实验室用带玻璃塞的棕色试剂瓶贮存液溴 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
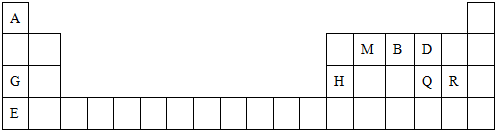
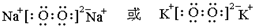 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.