题目内容
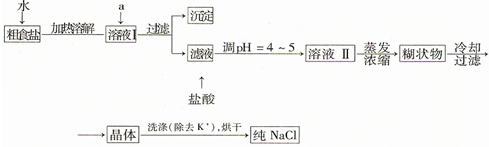
7.食盐是日常生活的必需品,也是重要的化工原料.(1)粗食盐常含有少量K+、Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次是BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH)(只填化学式).
②检验滤液中是否存在SO42-的方法是:取少量滤液于试管中,滴入BaCl2溶液,若未出现浑浊现象,则滤液中不存在SO42-.
③洗涤除去NaCl晶体表面的少量KCl,选用的试剂为75%乙醇(从提供的试剂中选择).
(2)用提纯的NaCl固体配制480mL 1.00mol•L-1 NaCl溶液,其实验步骤如下:
①计算所需氯化钠固体的质量.
②将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液一并注入容量瓶中,轻轻振荡.
③称量氯化钠固体的质量.
④继续向容量瓶中加蒸馏水至刻度线下1-2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切.
⑤用适量的蒸馏水溶解氯化钠固体.
⑥盖好瓶塞,摇匀.
Ⅰ.本实验操作步骤的正确顺序是:①③⑤②④⑥(填序号)
Ⅱ.实验中所用的主要仪器除药匙、托盘天平、烧杯、胶头滴管、玻璃棒外还有500mL容量瓶(填仪器名称).
Ⅲ.用托盘天平称取氯化钠固体的质量为:29.3g.
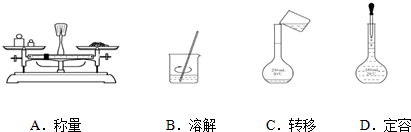
Ⅳ.如图图示对应的操作规范的是B
Ⅴ.实验过程中,若定容时俯视液面,使溶液浓度偏高(填“偏高”“偏低”或者“不变”).
分析 (1)①把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子、铁离子用氢氧根离子,除硫酸根离子用钡离子,要注意除杂质的顺序,后加的试剂最好能把前面先加的过量试剂除掉;
②用氯化钡溶液检验硫酸根离子的存在;
③根据题中提供的试剂,可以用75%乙醇洗涤氯化钠固体,可以除去表面的氯化钾,同时可以减少氯化钠的损失;
(2)Ⅰ.用氯化钠固体配制一定物质的量浓度的溶液,通常的步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等操作;
Ⅱ.根据这些操作可知所用的仪器;
Ⅲ.在计算溶质的质量时要按容量瓶的规格计算;
Ⅳ.用天平称物品时,物品在左边,砝码在右边;溶解时要用玻璃棒搅拌;向容量瓶中加液体时要用玻璃棒引流;定容时,滴管不能伸到容量瓶中;
Ⅴ.实验过程中,若定容时俯视液面,则所配制溶液的体积偏小,据此分析.
解答 解:(1)①除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,
故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
②检验滤液中是否存在SO42-的方法是:取少量滤液于试管中,滴入BaCl2溶液,若未出现浑浊现象,则滤液中不存在SO42-,
故答案为:取少量滤液于试管中,滴入BaCl2溶液,若未出现浑浊现象,则滤液中不存在SO42-;
③可用75%乙醇冲洗固体表面的氯化钾,这样可以减少晶体的损失,
故答案为:75%乙醇;
(2)Ⅰ.用氯化钠固体配制一定物质的量浓度的溶液,通常的步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,所以实验操作步骤的正确顺序是①③⑤②④⑥,
故答案为:①③⑤②④⑥;
Ⅱ.根据这些操作可知所用的仪器除药匙、托盘天平、烧杯、胶头滴管、玻璃棒外还有500 mL容量瓶,
故答案为:500 mL容量瓶;
Ⅲ.在计算溶质的质量时要按容量瓶的规格计算,所以配制480mL 1.00mol•L-1 NaCl溶液,需要氯化钠的质量为0.5L×1.00mol•L-1×58.5g/mol=29.3g,
故答案为:29.3;
Ⅳ.A、用天平称物品时,物品在左边,砝码在右边,故A错误;
B、溶解时要用玻璃棒搅拌,故B正确;
C、向容量瓶中加液体时要用玻璃棒引流,故C错误;
D、定容时,滴管不能伸到容量瓶中,故D错误,
故选B;
Ⅴ.实验过程中,若定容时俯视液面,则所配制溶液的体积偏小,会使溶液浓度偏高,
故答案为:偏高.
点评 本题主要考查了粗盐提纯过程中的除杂方面的知识,综合性强,难度一般,要注意除杂质选取和添加的先后顺序.

 阅读快车系列答案
阅读快车系列答案(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示.
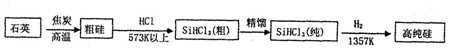
①写出由纯SiHCl3制备高纯硅的化学反应方程式SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2,可能引起的后果是高温下,H2遇O2发生爆炸.
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因:生成白色絮状沉淀,又刺激性气味的气体生成,SiO32-与NH4+发生双水解反应,生成氨气和硅酸沉淀.
①2O2(g)+N2(g)=N2O4,(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:1228.6.
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生.联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O21 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4.
| A. | 胶体粒子直径在1~100nm之间 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子能穿过滤纸 | D. | 胶体粒子能够发生布朗运动 |
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
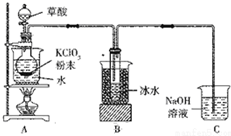 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示: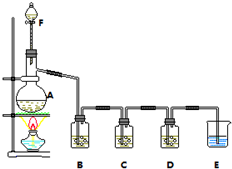 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.