题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA |
| B、标况下,22.4L NO与11.2L O2混合后气体的分子数为2NA |
| C、标准状况下,22.4 L己烷中共价键数目为19NA |
| D、常温常压下,将0.1mol Fe投入足量的浓硝酸中,转移的电子数为0.3 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据碳酸钠水解显碱性,结合溶液中离子积使常数计算分析;
B、由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数.
C、标况下,己烷为液态;
D、铁与足量浓硝酸反应后变为+3价.
B、由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数.
C、标况下,己烷为液态;
D、铁与足量浓硝酸反应后变为+3价.
解答:
解:A、25℃,pH=11的Na2CO3溶液中存在离子积常数,[H+]余=10-11mol/L;[H+]余?[OH-]水=10-14 ;由水电离出的[H+]=[OH-]=
=10-3mol/L;溶液体积不知,由水电离出的氢离子的数目无法计算,故A错误;
B、标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2?N2O4,则气体的分子总数小于NA个,故B错误.
C、标况下,己烷为液态,故C错误;
D、铁与足量浓硝酸发生钝化现象,所以铁不能完全反应,故D错误.
此题无答案.
| 10-14 |
| 10-11 |
B、标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2?N2O4,则气体的分子总数小于NA个,故B错误.
C、标况下,己烷为液态,故C错误;
D、铁与足量浓硝酸发生钝化现象,所以铁不能完全反应,故D错误.
此题无答案.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
0.1mol?L-1的稀盐酸与0.2mol?L-1醋酸钠溶液等体积完全反应后,测得反应后的溶液中c(CH3COO-)>c(Cl-),则下列判断中错误的是( )
| A、温度为298K时,pH<7 |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
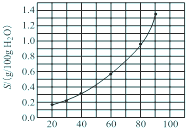 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )| A、温度升高时溴酸银溶解速度加快 |
| B、溴酸银的溶解是放热过程 |
| C、60℃时,溴酸银的Ksp约等于6×10-4 |
| D、常温下溴酸银微溶于水 |
下列说法中正确的是( )
| A、在酸性环境中钢铁发生析氢腐蚀 |
| B、电解质溶液为氢氧化钠溶液,铝和镁形成原电池时,镁作负极 |
| C、铅蓄电池中铅做正极,PbO2做负极,两极浸在H2SO4溶液中 |
| D、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
将一定质量的锌粉与100mL 18.5mol?L-1的浓H2SO4混合,充分反应后锌完全溶解,生成了标准状况下的混合气体33.6L(设浓H2SO4的还原产物只有SO2,稀硫酸只生成H2),将反应后的溶液稀释成1L时,溶液pH=1,参加反应的锌为( )
| A、0.9 mol |
| B、1.2 mol |
| C、1.5 mol |
| D、1.8 mol |
对同温同压下的两种气体12C18O和14N2的有关比较正确的是( )
| A、质量相等时所含质子数相等 |
| B、体积不相等时密度有可能相等 |
| C、体积相等时所含电子数相等 |
| D、原子数相等时所含中子数相等 |
已知Br2+2Fe2+═2Br-+2Fe3+,向FeBr2溶液中通入Cl2发生反应后,溶液中有一半的Br-被氧化,则FeBr2与Cl2物质的量之比是( )
| A、1:1 | B、2:3 |
| C、1:2 | D、3:5 |

 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白: