题目内容
利用氧化还原反应原理配平以下化学方程式,并:
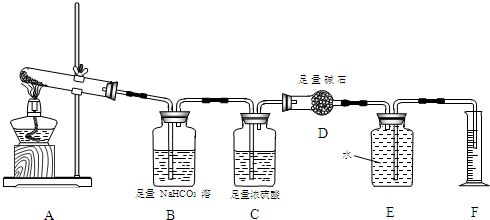
C+HNO3═CO2↑+NO2↑+H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.4mol时,有 g还原剂参加反应.
C+HNO3═CO2↑+NO2↑+H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.4mol时,有
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4,根据转移电子和碳之间的关系式计算.
解答:
解:(1)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为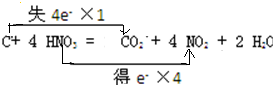 ,故答案为:
,故答案为: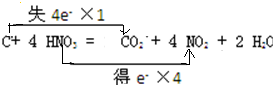 ;
;
(2)该反应中C作还原剂,根据方程式知,当电子转移了0.4mol时,参加反应的C的质量=
×12g/mol=1.2g,故答案为:1.2.
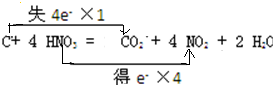 ,故答案为:
,故答案为: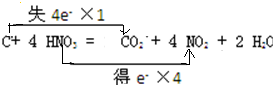 ;
;(2)该反应中C作还原剂,根据方程式知,当电子转移了0.4mol时,参加反应的C的质量=
| 0.4mol |
| 4 |
点评:本题考查了氧化还原反应,根据元素化合价变化确定转移电子数,再结合转移电子和C之间的关系式计算,难点是标电子转移的方向和数目,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离的c(H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、CH3COO- | ||
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- | ||
D、
|
下列离子反应方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、氢氧化铜和稀盐酸溶液反应:H++OH-═H2O |
| C、锌粒溶于醋酸溶液:Zn+2H+═Zn2++H2↑ |
| D、往盐酸中滴加少量Na2CO3溶液:CO32-+2H+═CO2↑+H2O |
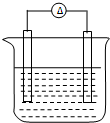 铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)
铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)