题目内容
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价.
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 .
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
A.锌铜原电池中铜是正极 B.用电解法精炼铜时粗铜作阴极
C.在镀件上镀铜时铜与电源正极相连 D.铜作阳极时不一定溶解
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究.
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验.
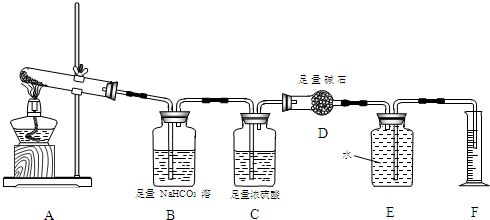
【实验过程】
a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO.
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g.
(3)装置C的作用 .
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol.
(5)装置A中反应的化学方程式为 .
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3.
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点).
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
A.锌铜原电池中铜是正极 B.用电解法精炼铜时粗铜作阴极
C.在镀件上镀铜时铜与电源正极相连 D.铜作阳极时不一定溶解
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究.
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验.

【实验过程】
a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO.
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g.
(3)装置C的作用
(4)根据装置E、F中现象,推测还有气体
(5)装置A中反应的化学方程式为
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3.
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是
考点:性质实验方案的设计,原电池和电解池的工作原理
专题:实验设计题,电化学专题
分析:Ⅰ(1)曾青(CuSO4)得铁则化为铜,是铁和硫酸铜反应生成硫酸亚铁和铜;
(2)A.锌铜原电池中较活泼的金属锌是负极,较不活泼的金属铜是正极;
B.用电解法精炼铜时粗铜作阳极;
C.在镀件上镀铜时铜与电源正极相连作阳极;
D.铜作阳极时是活性电极,一定溶解;
Ⅱ.(3)浓硫酸具有吸水性,能干燥酸性或中性气体;
(4)根据无水硫酸铜的组成元素、氧化还原反应中元素的化合价有升也有降以及该气体不溶于水来判断;根据氧化还原反应中元素的化合价有升也有降来判断产物并写出方程式、配平,根据方程式计算;
(5)根据氧化还原反应元素的化合价有升也有降来判断产物,根据化合价升降总数相等来配平;
(6)根据装置内部有气体滞留,气体吸收不完全;称量造成的误差;读数造成的误差等.
(2)A.锌铜原电池中较活泼的金属锌是负极,较不活泼的金属铜是正极;
B.用电解法精炼铜时粗铜作阳极;
C.在镀件上镀铜时铜与电源正极相连作阳极;
D.铜作阳极时是活性电极,一定溶解;
Ⅱ.(3)浓硫酸具有吸水性,能干燥酸性或中性气体;
(4)根据无水硫酸铜的组成元素、氧化还原反应中元素的化合价有升也有降以及该气体不溶于水来判断;根据氧化还原反应中元素的化合价有升也有降来判断产物并写出方程式、配平,根据方程式计算;
(5)根据氧化还原反应元素的化合价有升也有降来判断产物,根据化合价升降总数相等来配平;
(6)根据装置内部有气体滞留,气体吸收不完全;称量造成的误差;读数造成的误差等.
解答:
解:Ⅰ(1)曾青(CuSO4)得铁则化为铜,是铁和硫酸铜反应生成硫酸亚铁和铜,
反应的离子方程式为:Fe+Cu2+═Fe2++Cu;故答案为:Fe+Cu2+═Fe2++Cu;
(2)A.锌铜原电池中较活泼的金属锌是负极,较不活泼的金属铜是正极,故A正确;
B.用电解法精炼铜时粗铜作阳极,故B错误;
C.在镀件上镀铜时铜与电源正极相连作阳极,故C正确;
D.铜作阳极时是活性电极,一定溶解,故D错误;
故选:AC.
Ⅱ.(3)气体通过B装置后还剩二氧化硫和氧气、水蒸气,水蒸气能影响实验的测定,所以必须通过干燥剂吸收水分,所以浓硫酸的作用是:吸收水份干燥气体,
故答案为:吸收水份干燥气体;
(4)无水硫酸铜的组成元素以及该气体不溶于水,所以该气体为氧气,A装置加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,方程式为:3CuSO4
3CuO+2SO2↑+SO3↑+O2↑,O2的物质的量为:
=0.005mol,则SO3为0.005mol,故答案:O2;0.005mol;
(5)加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,方程式为:3CuSO4
3CuO+2SO2↑+SO3↑+O2↑,故答案为:3CuSO4
3CuO+2SO2↑+SO3↑+O2↑;
(6)装置内部有气体滞留,气体吸收不完全;称量造成的误差;读数造成的误差都是造成误差的因素,
故答案为:装置内部有气体滞留,气体吸收不完全;称量造成的误差.
反应的离子方程式为:Fe+Cu2+═Fe2++Cu;故答案为:Fe+Cu2+═Fe2++Cu;
(2)A.锌铜原电池中较活泼的金属锌是负极,较不活泼的金属铜是正极,故A正确;
B.用电解法精炼铜时粗铜作阳极,故B错误;
C.在镀件上镀铜时铜与电源正极相连作阳极,故C正确;
D.铜作阳极时是活性电极,一定溶解,故D错误;
故选:AC.
Ⅱ.(3)气体通过B装置后还剩二氧化硫和氧气、水蒸气,水蒸气能影响实验的测定,所以必须通过干燥剂吸收水分,所以浓硫酸的作用是:吸收水份干燥气体,
故答案为:吸收水份干燥气体;
(4)无水硫酸铜的组成元素以及该气体不溶于水,所以该气体为氧气,A装置加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,方程式为:3CuSO4
| ||
| 0.112L |
| 22.4L/mol |
(5)加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,方程式为:3CuSO4
| ||
| ||
(6)装置内部有气体滞留,气体吸收不完全;称量造成的误差;读数造成的误差都是造成误差的因素,
故答案为:装置内部有气体滞留,气体吸收不完全;称量造成的误差.
点评:本实验题综合性较强,难点是确定硫酸铜的分解方程式的书写,注意碱石灰吸收的二氧化硫有部分是硫酸铜分解生成的、部分是水、亚硫酸氢钠反应生成的二氧化硫.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA |
| B、常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA |
| C、标准状况下,2.24L NO2含原子总数一定等于0.3NA |
| D、将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA |
下列关于铝与钠的叙述中,不正确的是( )
| A、金属钠着火时,可用干沙来灭火 |
| B、铝性质活泼,在常温下能与氧气反应 |
| C、铝和钠是地壳里含量最多的前2种金属元素 |
| D、金属钠在空气中加热,先熔化成银白色小球,再燃烧发出黄色火焰,生成淡黄色的过氧化钠 |