题目内容
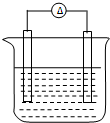 铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)
铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)(1)参与反应的铁的质量.
(2)硫酸铜溶液的浓度.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该电池反应式为CuSO4+Fe=FeSO4+Cu,固体质量增加的量为析出铜和溶解铁的质量差,
(1)利用差量法金属铁的质量;
(2)根据固体质量差与硫酸铜之间的关系式计算硫酸铜浓度.
(1)利用差量法金属铁的质量;
(2)根据固体质量差与硫酸铜之间的关系式计算硫酸铜浓度.
解答:
解:该电池反应式为CuSO4+Fe=FeSO4+Cu,固体质量增加的量为析出铜和溶解铁的质量差,固体增加的质量=61.6g-60g=1.6g,
(1)设溶解铁的质量是x,
CuSO4+Fe=FeSO4+Cu 固体质量差
56 64-56
x 1.6g
56:(64-56)=x:1.6g
x=
=11.2g,
答:参与反应的铁的质量是11.2g;
(2)设硫酸铜的浓度为ymol/L,
CuSO4+Fe=FeSO4+Cu 固体质量差
1mol (64-56)g
0.2ymol 1.6g
1mol:(64-56)g=0.2ymol:1.6g
y=
=1,
答:硫酸铜的物质的量浓度为1mol/L.
(1)设溶解铁的质量是x,
CuSO4+Fe=FeSO4+Cu 固体质量差
56 64-56
x 1.6g
56:(64-56)=x:1.6g
x=
| 56×1.6g |
| 64-56 |
答:参与反应的铁的质量是11.2g;
(2)设硫酸铜的浓度为ymol/L,
CuSO4+Fe=FeSO4+Cu 固体质量差
1mol (64-56)g
0.2ymol 1.6g
1mol:(64-56)g=0.2ymol:1.6g
y=
| 1mol×1.6g |
| (64-56)g×0.2 |
答:硫酸铜的物质的量浓度为1mol/L.
点评:本题以原电池原理为载体考查了物质的量的有关计算,明确固体增加的量是什么为解本题关键,利用差量法来分析解答即可,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中,既有离子键又有非极性键的化合物是( )
| A、NH4Cl |
| B、Na2O2 |
| C、CO2 |
| D、MgCl2 |
在卤代烃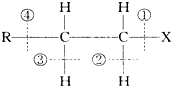 中化学键的叙述中,下列说法不正确的是( )
中化学键的叙述中,下列说法不正确的是( )
 中化学键的叙述中,下列说法不正确的是( )
中化学键的叙述中,下列说法不正确的是( )| A、当该卤代烃发生取代反应时,被破坏的键是①和② |
| B、当该卤代烃发生消去反应时,被破坏的键是①和③ |
| C、当该卤代烃在碱性条件下发生水解反应时被破坏的键是① |
| D、当该卤代烃发生消去反应时,被破坏的键是①和④ |

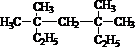 系统命名为
系统命名为