题目内容
4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .
.
在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
(1)开始时先通入N2的目的是 .
(2)上述实验中过滤的目的是 ,洗涤所用的试剂是 .
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有: 、 .馏出液的主要成分是 .
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
优化的条件是:温度、氢气压力、催化剂用量、吗啉用量,选择的序号依次是 .
 .
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
 )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.(1)开始时先通入N2的目的是
(2)上述实验中过滤的目的是
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有:
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% | 反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
考点:物质分离和提纯的方法和基本操作综合应用,物质分离、提纯的实验方案设计
专题:实验设计题
分析:(1)装置中含有空气,生成的4-氯苯胺容易被氧化,氢气和氧气混合受热容易爆炸;
(2)催化剂雷尼镍是固体,过滤分离出催化剂;
由题目可知,甲醇在反应中起溶剂的作用,催化剂上附着4-氯硝基苯等,可以用甲醇洗涤;
(3)蒸馏时用到比例仪器有:接引管、锥形瓶、温度计、蒸馏烧瓶、冷凝管;
蒸馏并收集64~65℃馏分,主要是将溶剂甲醇分离出来;
(4)温度主要考虑选择性与转化率,在转化率为100%的情况下,选择性相差不大,主要考虑反应速率;
压强主要考虑选择性,在选择性相差不大的情况下,主要考虑反应时间;
催化剂主要考虑选择性,在选择性相差不大的情况下,主要考虑催化剂用量与反应速率;
吗啉用量考虑选择性高、用量少.
(2)催化剂雷尼镍是固体,过滤分离出催化剂;
由题目可知,甲醇在反应中起溶剂的作用,催化剂上附着4-氯硝基苯等,可以用甲醇洗涤;
(3)蒸馏时用到比例仪器有:接引管、锥形瓶、温度计、蒸馏烧瓶、冷凝管;
蒸馏并收集64~65℃馏分,主要是将溶剂甲醇分离出来;
(4)温度主要考虑选择性与转化率,在转化率为100%的情况下,选择性相差不大,主要考虑反应速率;
压强主要考虑选择性,在选择性相差不大的情况下,主要考虑反应时间;
催化剂主要考虑选择性,在选择性相差不大的情况下,主要考虑催化剂用量与反应速率;
吗啉用量考虑选择性高、用量少.
解答:
解:(1)装置中含有空气,生成的4-氯苯胺容易被氧化,氢气和氧气混合受热容易爆炸,开始通入氮气除去装置中的空气,防止生成的4-氯苯胺被氧化,防止氢气和氧气混合受热爆炸,
故答案为:除去装置中的空气,防止生成的4-氯苯胺被氧化,防止氢气和氧气混合受热爆炸;
(2)催化剂雷尼镍是固体,过滤分离出催化剂,由题目可知,甲醇在反应中起溶剂的作用,催化剂上附着4-氯硝基苯等,可以用甲醇洗涤,
故答案为:分离出催化剂;甲醇;
(3)蒸馏时用到比例仪器有:接引管、锥形瓶、温度计、蒸馏烧瓶、冷凝管,蒸馏并收集64~65℃馏分,主要是将溶剂甲醇分离出来,蒸馏出的馏分主要是甲醇,
故答案为:蒸馏烧瓶;冷凝管;甲醇;
(4)由表中数据可知,在转化率为100%的情况下,60℃、80℃、100℃选择性相差不大,100℃反应时间最短,反应速率更快,120℃反应速率变化不大,选择性降低较多,故选择100℃较好,
压力为2.0MPa,选择性较0.5MPa、1.0MPa、1.5MPa低很多,在1.0MPa时选择性最高,反应速率较快,故选择压力为1.0MPa较好,
由表中数据可知,催化剂在6g、8g时选择性最高,8g时速率加快不是很多,增大了催化剂的用量,故选择催化剂为6g相等较好,
由表中数据可知,吗啉用量为0.5%、1.2%选择性最高,选择吗啉用量较少的0.5%较好,
故答案为:④②③③.
故答案为:除去装置中的空气,防止生成的4-氯苯胺被氧化,防止氢气和氧气混合受热爆炸;
(2)催化剂雷尼镍是固体,过滤分离出催化剂,由题目可知,甲醇在反应中起溶剂的作用,催化剂上附着4-氯硝基苯等,可以用甲醇洗涤,
故答案为:分离出催化剂;甲醇;
(3)蒸馏时用到比例仪器有:接引管、锥形瓶、温度计、蒸馏烧瓶、冷凝管,蒸馏并收集64~65℃馏分,主要是将溶剂甲醇分离出来,蒸馏出的馏分主要是甲醇,
故答案为:蒸馏烧瓶;冷凝管;甲醇;
(4)由表中数据可知,在转化率为100%的情况下,60℃、80℃、100℃选择性相差不大,100℃反应时间最短,反应速率更快,120℃反应速率变化不大,选择性降低较多,故选择100℃较好,
压力为2.0MPa,选择性较0.5MPa、1.0MPa、1.5MPa低很多,在1.0MPa时选择性最高,反应速率较快,故选择压力为1.0MPa较好,
由表中数据可知,催化剂在6g、8g时选择性最高,8g时速率加快不是很多,增大了催化剂的用量,故选择催化剂为6g相等较好,
由表中数据可知,吗啉用量为0.5%、1.2%选择性最高,选择吗啉用量较少的0.5%较好,
故答案为:④②③③.
点评:本题考查混合物分离提纯的综合应用,为高频考点,涉及有机物的制备及分离提纯等,把握物质的性质、数据分析及应用为解答的关键,侧重分析与实验能力的考查,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、制阿司匹林时用水洗涤产品,而在制摩尔盐时用酒精洗涤产品 |
| B、纸层析法通常把不与水混溶的有机溶剂作为固定相 |
| C、中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤 |
新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:下列说法正确的是( )
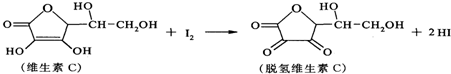

| A、上述反应为取代反应 |
| B、维生素C在酸性条件下水解只得到1种产物 |
| C、维生素C具有氧化性 |
| D、脱氢维生素C的分子式为C6H6O6 |
下列有关实验现象或操作预测的叙述正确的是( )
A、 可用于分离乙醇和水 |
B、 说明该装置气密性良好 |
C、 该装置可用于制取并收集乙酸乙酯 |
D、 由a进气可用于收集NH3 |
 .
.