题目内容
将3.36L标准状态下的氨气完全溶于水配成500mL氨水,然后与0.2mol/L Fe2(SO4)3溶液反应.计算氨水完全反应需0.2mol/L Fe2(SO4)3溶液多少毫升.
考点:化学方程式的有关计算
专题:计算题
分析:氨气溶于水和水结合现场一水合氨,一水合氨和铁离子反应生成氢氧化铁沉淀,根据方程式计算需要硫酸铁的体积.
解答:
解:3.36L氨气的物质的量为:
=0.15mol,氨气溶于水和水结合现场一水合氨,一水合氨和铁离子反应生成氢氧化铁沉淀,反应的离子方程式为:
3NH3?H2O+Fe3+=Fe(OH)3↓+3NH4+
3mol 1mol
0.15mol n
n=
=0.05mol,硫酸铁物质的量为:0.025mol,需要硫酸铁的体积为:
V=
=0.125L=125mL,
答:氨水完全反应需要0.2mol/L Fe2(SO4)3溶液125毫升.
| 3.36L |
| 22.4L/mol |
3NH3?H2O+Fe3+=Fe(OH)3↓+3NH4+
3mol 1mol
0.15mol n
n=
| 0.15mol×1mol |
| 3mol |
V=
| 0.025mol |
| 0.2mol/L |
答:氨水完全反应需要0.2mol/L Fe2(SO4)3溶液125毫升.
点评:本题考查了根据方程式的计算,较简单,注意铁离子浓度和硫酸铁浓度的关系,本题中500mL氨水和解题无关.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
| C、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| D、由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨比金刚石稳定 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
| 放电 |
| 通电 |
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?
N2(g)+CO2(g)△H=-373.4kJ?mol-1在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
| 1 |
| 2 |
A、 |
B、 |
C、 |
D、 |
下列溶液中,微粒的物质的量浓度正确的是( )
| A、在Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
| B、常温时,将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)=0.2mol |

 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式
 ”的反应中属于取代反应的是
”的反应中属于取代反应的是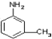 中的所有原子是否在同一平面上
中的所有原子是否在同一平面上 .
. )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.