题目内容
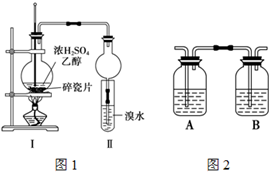 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.(1)写出该实验中生成乙烯的化学方程式
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是
a.乙烯与溴水易发生取代反应?b.使溴水褪色的反应,未必是加成反应?c.使溴水褪色的物质,未必是乙烯?
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是
(5)处理上述实验后烧瓶中废液的正确方法是
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中
c.冷却后加水稀释,倒入废液缸中,加废碱中和.
考点:性质实验方案的设计
专题:实验题
分析:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫具有还原性;
(3)反应生成的乙烯与试管中的溴水加成反应生成不溶于水的油状物质;如果发生取代反应生成物含有HBr,溶液酸性增强;
(4)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要先稀释再加废碱中和处理.
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫具有还原性;
(3)反应生成的乙烯与试管中的溴水加成反应生成不溶于水的油状物质;如果发生取代反应生成物含有HBr,溶液酸性增强;
(4)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要先稀释再加废碱中和处理.
解答:
解:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH
H2O+CH2=CH2↑,
故答案为:CH3CH2OH
H2O+CH2=CH2↑;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4
CO2↑+2SO2↑+2H2O,SO2具有还原性,
可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以bc正确,故选:bc;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
故答案为:观察到液体分层,油状液体在下层,证明有溴代烃生成;用pH试纸测定水溶液的pH增大,证明发生加成反应,若发生取代反应则生成HBr,水溶液的pH会明显减小;
(4)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,故答案为:NaOH溶液;品红溶液;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,要先稀释,再加废碱中和,故选c.
| 浓H2SO4 |
| 170℃ |
故答案为:CH3CH2OH
| 浓H2SO4 |
| 170℃ |
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4
| ||
可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以bc正确,故选:bc;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小;
故答案为:观察到液体分层,油状液体在下层,证明有溴代烃生成;用pH试纸测定水溶液的pH增大,证明发生加成反应,若发生取代反应则生成HBr,水溶液的pH会明显减小;
(4)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,故答案为:NaOH溶液;品红溶液;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,要先稀释,再加废碱中和,故选c.
点评:本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应.

练习册系列答案
相关题目
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、0.5molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为1 NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
对下列定量实验中的基本操作和仪器的描述正确的是( )
| A、用托盘天平称取 NaOH固体20.0 g |
| B、将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH |
| C、滴定管的0刻度线在上部,而量筒的0刻度线在下部 |
| D、在配制一定物质的量浓度的溶液时,定容后,经摇匀后发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度持平 |
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:

 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律