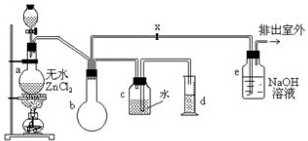
题目内容
一种被称为联氨或肼的易溶于水的液体,它的分子式是N2H4,试分析其结构和性质.
(1)写出联氨分子的结构式;
(2)a mol N2H4所能结合的H+的物质的量为多少?N2H4是通过怎样的化学键来结合H+的?
(3)写出联氨与相等物质的量的硫酸反应,生成可溶性离子化合物(硫酸肼)的离子方程式.
(1)写出联氨分子的结构式;
(2)a mol N2H4所能结合的H+的物质的量为多少?N2H4是通过怎样的化学键来结合H+的?
(3)写出联氨与相等物质的量的硫酸反应,生成可溶性离子化合物(硫酸肼)的离子方程式.
考点:含氮物质的综合应用
专题:氮族元素
分析:(1)联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键;
(2)依据联氨结构分析,氮原子含有一对孤对电子可以结合氢离子形成配位键分析;
(3)联氨与相等物质的量的硫酸反应,生成可溶性离子化合物硫酸肼,结合一个氢离子形成.
(2)依据联氨结构分析,氮原子含有一对孤对电子可以结合氢离子形成配位键分析;
(3)联氨与相等物质的量的硫酸反应,生成可溶性离子化合物硫酸肼,结合一个氢离子形成.
解答:
解:(1)联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,结构式为: ,
,
答:联氨分子的结构式为 ;
;
(2)每个氮原子含有一对孤对电子可以结合氢离子形成配位键,a mol N2H4所能结合的H+的物质的量为2amol,N2H4是通过共价键中的配位键形成化学键结合H+的;
答:a mol N2H4所能结合的H+的物质的量为2amol,N2H4是通过氮原子提供孤对电子形成的配位键来结合H+的;
(3)联氨与相等物质的量的硫酸反应,生成可溶性离子化合物硫酸肼,结合一个氢离子形成,离子方程式为:N2H4+H+=[N2H5]+;
答:联氨与相等物质的量的硫酸反应,生成可溶性离子化合物(硫酸肼)的离子方程式为:N2H4+H+=[N2H5]+.
 ,
,答:联氨分子的结构式为
 ;
;(2)每个氮原子含有一对孤对电子可以结合氢离子形成配位键,a mol N2H4所能结合的H+的物质的量为2amol,N2H4是通过共价键中的配位键形成化学键结合H+的;
答:a mol N2H4所能结合的H+的物质的量为2amol,N2H4是通过氮原子提供孤对电子形成的配位键来结合H+的;
(3)联氨与相等物质的量的硫酸反应,生成可溶性离子化合物硫酸肼,结合一个氢离子形成,离子方程式为:N2H4+H+=[N2H5]+;
答:联氨与相等物质的量的硫酸反应,生成可溶性离子化合物(硫酸肼)的离子方程式为:N2H4+H+=[N2H5]+.
点评:本题考查了氮的化合物结构性质的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法中错误的是( )
| A、NaHCO3溶液中碳元素主要以HCO3-存在 |
| B、Na2CO3溶液中滴加酚酞呈红色,加热红色变深 |
| C、NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱 |
| D、在稀醋酸中加醋酸钠固体能促进醋酸的电离 |
下列说法错误的是( )
| A、1mol任何粒子的数目都约为6.02×1023 |
| B、0.012kg 12C约含6.02×1023个碳原子 |
| C、使用物质的量时,应用化学式指明粒子的种类 |
| D、O2的摩尔质量等于它的相对分子质量 |