题目内容
查资料得知有些硫酸盐在500℃以上开始按下式分解:
硫酸盐
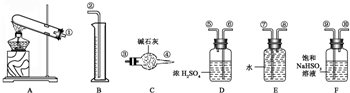
金属氧化物+SO2↑+SO3↑+O2↑,有人猜测硫酸亚铁可能也是如此分解,并设计一验证性实验.(注:忽略气体吸收过程中的热效应)实验用到的仪器如图所示:
使用精密实验仪器,加热一段时间后,测得数据及有关结果如下:
Ⅰ、准确称取6.08g无水FeSO4;
Ⅱ、装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质;
Ⅲ、测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL.
试回答下列问题:
(1)使用所有仪器,按装置从左至右的方向,各仪器接口连接顺序为①⑨⑩ ③ ②(填序号).
(2)装置F的作用是 .
(3)装置D的作用是 .
(4)通过计算,推断出该条件下反应的化学方程式: .
(5)本题测量气体体积时的注意事项是:① ② ③待气体冷却到室温时再读数.
(6)若将上面连接中的F装置去掉,则本实验是否还能进行? .
(若能,请填写可能还需要测量什么数据;若不能,请说明理由)
硫酸盐
| △ |

使用精密实验仪器,加热一段时间后,测得数据及有关结果如下:
Ⅰ、准确称取6.08g无水FeSO4;
Ⅱ、装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质;
Ⅲ、测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL.
试回答下列问题:
(1)使用所有仪器,按装置从左至右的方向,各仪器接口连接顺序为①⑨⑩
(2)装置F的作用是
(3)装置D的作用是
(4)通过计算,推断出该条件下反应的化学方程式:
(5)本题测量气体体积时的注意事项是:①
(6)若将上面连接中的F装置去掉,则本实验是否还能进行?
(若能,请填写可能还需要测量什么数据;若不能,请说明理由)
考点:性质实验方案的设计
专题:实验设计题
分析:(1)猜测发生反应,硫酸盐
金属氧化物+SO2↑+SO3↑+O2↑,固体受热分解连接顺序为试管中加热,根据气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来组装实验仪器;
(2)加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,硫酸能和亚硫酸氢钠反应生成二氧化硫;
(3)浓硫酸具有吸水性,能干燥酸性或中性气体;
(4)1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01摩尔;在标准状况下的氧气体积为112 mL,即得到氧气0.005ml;6.08 g无水FeSO4的物质的量是
=0.04mol,利用铁元素守恒得生成Fe2O3的物质的量是0.02mol;通过质量守恒即可计算生成SO2的物质的量是0.03mol;
(5)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,视线与液体的凹液面相平;
(6)F装置去掉,实验还能进行,需要测定装置D的增重,得到三氧化硫质量.
| △ |
(2)加热硫酸铜生成三氧化硫和氧气、二氧化硫、和氧化铜,硫酸能和亚硫酸氢钠反应生成二氧化硫;
(3)浓硫酸具有吸水性,能干燥酸性或中性气体;
(4)1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01摩尔;在标准状况下的氧气体积为112 mL,即得到氧气0.005ml;6.08 g无水FeSO4的物质的量是
| 6.08g |
| 152g/mol |
(5)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,视线与液体的凹液面相平;
(6)F装置去掉,实验还能进行,需要测定装置D的增重,得到三氧化硫质量.
解答:
解:(1)气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先制备气体,通过亚硫酸氢钠吸收三氧化硫,再通过浓硫酸干燥二氧化硫气体和氧气,通过碱石灰吸收二氧化硫称量计算,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为:①⑨⑩⑥⑤③④⑧⑦②;
故答案为:⑥⑤、④⑧⑦;
(2)加热硫酸铜生成氧化铜、三氧化硫、二氧化硫和氧气,三氧化硫易溶于水生成硫酸,硫酸能和亚硫酸氢钠反应生成二氧化硫,所以亚硫酸氢钠的作用是吸收SO3,放出等物质的量的SO2,
故答案为:吸收SO3放出等物质的量的SO2;
(3)气体通过F装置后还剩二氧化硫和氧气、水蒸气,水蒸气能影响实验的测定,所以必须通过干燥剂吸收水分,所以浓硫酸的作用是:吸收水分,干燥SO2和O2,
故答案为:干燥SO2和O2;
(4)Ⅰ、准确称取6.08g无水FeSO4;
Ⅱ、装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质,吸收的为;
Ⅲ、测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL
1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01摩尔;在标准状况下的氧气体积为112 mL,即得到氧气0.005ml;6.08 g无水FeSO4的物质的量是
=0.04mol,利用铁元素守恒得生成Fe2O3的物质的量是0.02mol;通过质量守恒即可计算生成SO2的物质的量是0.03mol,反应方程式为:8FeSO4=4Fe2O3+6SO2↑+2SO3↑+O2↑;
故答案为:8FeSO4=4Fe2O3+6SO2↑+2SO3↑+O2↑;
(5)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,由于量筒中液面是凹液面,所以读量筒中液体体积时,视线与液体的凹液面相平,否则会造成误差,
故答案为:视线要与凹液面最低处保持水平,读数时BE两仪器内液面要相平;
(6)若将上面连接中的F装置去掉,由于D 中的浓硫酸也能吸收SO3,仍然能完成实验,还需测量D装置反应前后的质量变化值需要测定装置D的增重,得到三氧化硫质量;
故答案为:能,还需测量D装置反应前后的质量变化值.
故答案为:⑥⑤、④⑧⑦;
(2)加热硫酸铜生成氧化铜、三氧化硫、二氧化硫和氧气,三氧化硫易溶于水生成硫酸,硫酸能和亚硫酸氢钠反应生成二氧化硫,所以亚硫酸氢钠的作用是吸收SO3,放出等物质的量的SO2,
故答案为:吸收SO3放出等物质的量的SO2;
(3)气体通过F装置后还剩二氧化硫和氧气、水蒸气,水蒸气能影响实验的测定,所以必须通过干燥剂吸收水分,所以浓硫酸的作用是:吸收水分,干燥SO2和O2,
故答案为:干燥SO2和O2;
(4)Ⅰ、准确称取6.08g无水FeSO4;
Ⅱ、装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质,吸收的为;
Ⅲ、测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL
1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01摩尔;在标准状况下的氧气体积为112 mL,即得到氧气0.005ml;6.08 g无水FeSO4的物质的量是
| 6.08g |
| 152g/mol |
故答案为:8FeSO4=4Fe2O3+6SO2↑+2SO3↑+O2↑;
(5)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,由于量筒中液面是凹液面,所以读量筒中液体体积时,视线与液体的凹液面相平,否则会造成误差,
故答案为:视线要与凹液面最低处保持水平,读数时BE两仪器内液面要相平;
(6)若将上面连接中的F装置去掉,由于D 中的浓硫酸也能吸收SO3,仍然能完成实验,还需测量D装置反应前后的质量变化值需要测定装置D的增重,得到三氧化硫质量;
故答案为:能,还需测量D装置反应前后的质量变化值.
点评:本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,本题具有一定难度.难点是确定硫酸铜的分解方程式的书写,注意碱石灰吸收的二氧化硫有部分是硫酸亚铁分解生成的、部分是三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,否则会导致计算错误.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| C、向硝酸银溶液中逐滴滴入稀氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |