题目内容
2.关于如图中各装置的叙述正确的是( )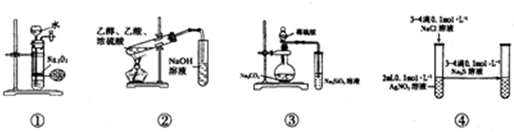
| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
分析 A.过氧化钠为粉末状,且与水反应剧烈;
B.乙酸乙酯在氢氧化钠溶液中水解;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.从难溶电解质的溶解平衡的角度以及硝酸银是否过量分析.
解答 解:A.过氧化钠为粉末状,且与水反应剧烈,不能控制反应,故A错误;
B.乙酸乙酯在氢氧化钠溶液中水解,应用饱和碳酸钠溶液,故B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,根据反应现象,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸,可比较非金属性强弱,故C正确;
D.硝酸银过量,加入硫化钠肯定生成Ag2S沉淀,不能证明AgCl和Ag2S的溶解度大小,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、检验等基本实验操作的考查,为高考常见题型和高频考点,侧重于实验方案的评价,注意把握物质的性质以及操作要点,题目难度不大.

练习册系列答案
相关题目
2.已知反应A(g)+B(g)═C(g)+D(s) 的能量变化如图所示,下列说法正确的是( )

| A. | 该反应的能量变化表现为释放能量 | |
| B. | 该反应中反应物A、B的总能量小于生成物C的能量 | |
| C. | 该反应的能量变化是将化学能转化为热能、电能等其它形式 | |
| D. | 该反应能量变化的实质是旧化学键断裂与新化学键形成的结果 |
3.下列有关物质用途的说法中,正确的是( )
| A. | 小苏打常用于配制波尔多液 | B. | 氮气、氨和干冰常用作制冷剂 | ||
| C. | Fe3O4常用作红色油漆和涂料 | D. | Na2O常用作呼吸面具中氧气的来源 |
10.下列离子方程式正确的是( )
| A. | 将过量二氧化硫通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
14.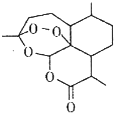 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 能与Cl2发生取代反应 | D. | 能与NaOH溶液反应 |
11.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是d e.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
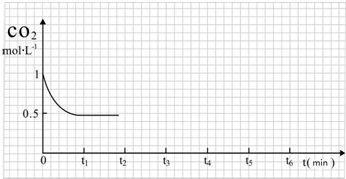
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ).
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是d e.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
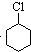 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$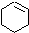 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$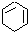 $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
.