题目内容
14. 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 能与Cl2发生取代反应 | D. | 能与NaOH溶液反应 |
分析 由结构简式可知分子式,含-COOC-、醚键、饱和烃基,结合酯的性质来解答.
解答 解:A.由结构简式可知青蒿素的分子式为C15H22O5,故A正确;
B.青蒿素中没有苯环,不是芳香族化合物,故B错误;
C.根据结构中含有饱和烃基,可以与氯气在光照条件下发生取代反应,故C正确;
D.含有酯基,可在碱性条件下水解,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、酚性质的考查,题目难度中等.

练习册系列答案
相关题目
14.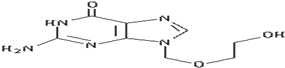 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
①分子中最多有12个原子在同一平面内;
②属于芳香族化合物;
③是一种易溶于水的醇;
④可以被氧化;⑤可以水解;
⑥可以燃烧;
⑦1mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;
⑧分子式是C8H13N5O3.
 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )①分子中最多有12个原子在同一平面内;
②属于芳香族化合物;
③是一种易溶于水的醇;
④可以被氧化;⑤可以水解;
⑥可以燃烧;
⑦1mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;
⑧分子式是C8H13N5O3.
| A. | ①②③④⑥⑧ | B. | ②④⑤⑥ | C. | ③④⑥⑧ | D. | ④⑥⑧ |
5.下列对一些氢化物的沸点的比较中,错误的是( )
| A. | H2O>H2Te>H2Se>H2S | B. | HF>HI>HBr>HCl | ||
| C. | SbH3>NH3>AsH3>PH3 | D. | H2O>NH3>HF>CH4 |
2.关于如图中各装置的叙述正确的是( )


| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
9.草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:氧化亚铁和四氧化三铁的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑.

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:氧化亚铁和四氧化三铁的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红,则假设一成立,若溶液变红,则假设一不成立 |

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.
19.下列实验叙述正确的是( )
| A. | 用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率 | |
| B. | 配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果 | |
| D. | 用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小 |
6.下列说法正确的是( )
| A. | 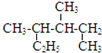 的系统命名是2,3-二甲基戊烷 的系统命名是2,3-二甲基戊烷 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与足量的氢气充分反应后的产物也不是同系物 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量相等 |
4.工业合成尿素反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: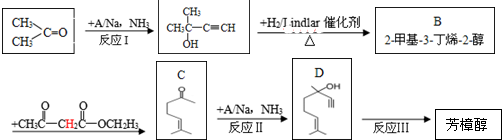
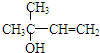 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.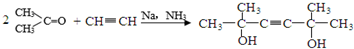 .
. ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)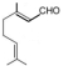 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(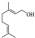 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD