题目内容
2.已知反应A(g)+B(g)═C(g)+D(s) 的能量变化如图所示,下列说法正确的是( )
| A. | 该反应的能量变化表现为释放能量 | |
| B. | 该反应中反应物A、B的总能量小于生成物C的能量 | |
| C. | 该反应的能量变化是将化学能转化为热能、电能等其它形式 | |
| D. | 该反应能量变化的实质是旧化学键断裂与新化学键形成的结果 |
分析 A、图象分析可知反应过程中反应物能量低于生成物能量,反应是吸热反应;
B、图象分析可知反应过程中反应物能量低于生成物;
C、依据反应实质分析,断裂化学键吸收能量,形成化学键放出能量 过程中一定伴随能量变化,但不一定是氧化还原反应,无电能产生;
D、依据反应实质分析,断裂化学键吸收能量,形成化学键放出能量 过程中一定伴随能量变化.
解答 解:A、图象分析可知反应过程中反应物能量低于生成物能量,反应是吸热反应,故A错误;
B、图象分析可知反应过程中反应物总能量低于生成物总能量,AB能量低于CD总能量,但该反应中反应物A、B的总能量不一定小于生成物C的能量,故B错误;
C、图象分析反应物总能量低于生成物总能量,结合能量守恒分析反应是吸热反应,该反应的能量变化是将化学能转化为热能,反应不一定是氧化还原反应,无电子转移形成电流,故C错误;
D、断裂化学键吸收能量,形成化学键放出能量,反应中断开化学键吸收的总能量高于形成化学键放出的总能量,所以形成C、D键释放的总能量大于断A、B键吸收的总能量,表现为反应吸热,该反应能量变化的实质是旧化学键断裂与新化学键形成的结果,故D正确;
故选D.
点评 本题考查了化学反应能量变化分析,图象分析方法和应用,注意反应吸热放热和反应条件关系的判断应用,题目较简单.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
12.已知乙醇的化学键类型如图所示,下列说法正确的是( )
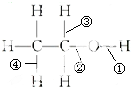

| A. | 乙醇与金属钠反应断裂②键 | B. | 乙醇与溴化氢反应断裂①键 | ||
| C. | 乙醇催化氧化变乙醛断裂①③键 | D. | 乙醇分子内脱水断裂①③键 |
13.下列化学用语表述正确的是( )
| A. | 二氧化硅的分子式:SiO2 | B. | 次氯酸的电子式: | ||
| C. | Cl─的结构示意图: | D. | 四氯化碳的比例模型: |
10.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃水浴加热反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 实验室用无水酒精和浓硫酸共热制备乙烯,温度过高,很可能生成乙醚副产物 | |
| D. | 工业上用乙烯水化法制备酒精 |
7.根据表中有关短周期元素性质的数据,判断下列说法中正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素②与元素③处于同一周期 | |
| B. | 元素④的原子序数小于元素⑦的 | |
| C. | 元素⑧的还原性比元素⑥的强 | |
| D. | 元素⑤的最高价氧化物对应水化物的酸性最强 |
14.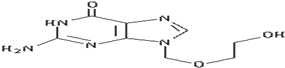 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
①分子中最多有12个原子在同一平面内;
②属于芳香族化合物;
③是一种易溶于水的醇;
④可以被氧化;⑤可以水解;
⑥可以燃烧;
⑦1mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;
⑧分子式是C8H13N5O3.
 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )①分子中最多有12个原子在同一平面内;
②属于芳香族化合物;
③是一种易溶于水的醇;
④可以被氧化;⑤可以水解;
⑥可以燃烧;
⑦1mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;
⑧分子式是C8H13N5O3.
| A. | ①②③④⑥⑧ | B. | ②④⑤⑥ | C. | ③④⑥⑧ | D. | ④⑥⑧ |
11.含有非极性键和离子键的晶体是( )
| A. | N2 | B. | Na2O2 | C. | 金刚石 | D. | NH4Cl |
2.关于如图中各装置的叙述正确的是( )
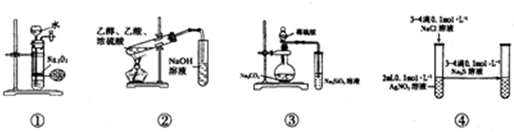

| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |