题目内容
13.根据热化学方程式:S(g)+O2(g)═SO2(g)△H=-Q KJ•mol-1,下列分析正确的是( )| A. | 该反应的反应物总能量比产物总能量低QkJ | |
| B. | 1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 | |
| C. | 在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量 |
分析 A、反应放热,反应物能量高;
B、热化学方程式的化学计量数表示物质的量;
C.状态不同反应的焓变不同,放热反应焓变为负值,结合盖斯定律分析判断;
D、热化学方程式的化学计量数只表示物质的量.
解答 解:A、△H<0,反应放热,反应物能量高,故A错误;
B、S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1,热化学方程式的化学计量数表示物质的量,1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量,故B正确;
C、固体硫变化为气体硫吸热,焓变为负值,S(s)+O2(g)=SO2(g)△H>-Q kJ•mol-1 ,故生成1 mol SO2(g)放出的热量小于Q KJ,故C错误;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数,故D错误;
故选B.
点评 本题考查对热化学方程式的理解,特别是其化学计量数只表示物质的量.题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
1. 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热.
根据以上所有内容回答下列问题:
(1)装置e的作用是冷凝收集产品,并防止倒吸;
(2)写出d中发生反应的化学方程式2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出'化学反应方程式CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如表):
①实验1和实验2,探究的实验目的是温度对反应速率的影响.
②当银氨溶液的量为lmL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为5~6.5min.(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有乙酸
(填物质名称),要除去该物质,可先在混合液中加入C(填写下列选项中的字母),然
后再通过蒸馏(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4.
 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热.
根据以上所有内容回答下列问题:
(1)装置e的作用是冷凝收集产品,并防止倒吸;
(2)写出d中发生反应的化学方程式2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出'化学反应方程式CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如表):
| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
②当银氨溶液的量为lmL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为5~6.5min.(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有乙酸
(填物质名称),要除去该物质,可先在混合液中加入C(填写下列选项中的字母),然
后再通过蒸馏(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4.
8.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在容积为2L的密闭容器中进行.在2s内用NH3浓度的减少来表示的平均反应速率为0.3mol•L-1•s-1,在2s时,H2O增加的物质的量为( )
| A. | 1.8mol | B. | 1.2mol | C. | 0.9mol | D. | 0.8mol |
18. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)写出CO2的结构式O=C=O,N2的电子式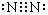 .
.
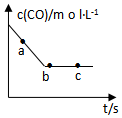
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c);
②下列可说明反应到达图中c点的是BC;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
【结论】①实验编号Ⅱ的实验目的为探究催化剂比表面积对反应速率的影响.
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是温度,且升高温度反应速率将增大.(填“增大”、“减小”、“无影响”).
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)写出CO2的结构式O=C=O,N2的电子式
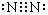 .
.(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c);
②下列可说明反应到达图中c点的是BC;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是温度,且升高温度反应速率将增大.(填“增大”、“减小”、“无影响”).


 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8. 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.