题目内容
15.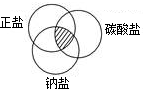 对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.
对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.
分析 交叉分类法是对同一化学物质或化学反应采用不同的“标准”进行分类;阴影部分同时属于正盐、钠盐、碳酸盐.
解答 解:碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液可通过交叉分类法分类,如分为纯净物、混合物、化合物等;阴影部分同时属于正盐、钠盐、碳酸盐,可为碳酸钠,故答案为:交叉分类;Na2CO3.
点评 本题考查了分散系的组成及分类,题目难度不大,注意明确分类方法的特点,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2. 如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
有关数据列表如下:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,使用连通滴液漏斗相比使用分液漏斗滴加液体的优点是能使连通滴液漏斗里的溶液容易滴下;B中插长玻璃管的作用有:稳压作用,可检查装置是否发生堵塞.
(2)写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O;装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)装置F的作用是吸收挥发出的溴蒸汽,减少对环境的污染;写出F装置中发生反应的化学方程式Br2+2NaOH=NaBr+NaBrO+H2O.
 如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(2)写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O;装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)装置F的作用是吸收挥发出的溴蒸汽,减少对环境的污染;写出F装置中发生反应的化学方程式Br2+2NaOH=NaBr+NaBrO+H2O.
3.取两份100ml Na2CO3溶液与两份50ml 1mol/L的盐酸,在不断搅拌下,将Na2CO3溶液逐滴滴入盐酸中与将盐酸逐滴滴入Na2CO3溶液中,所产生的气体物质的量之比为5:2.则Na2CO3溶液的物质的量浓度为( )
| A. | 0.2 mol/L | B. | 0.32 mol/L | C. | 0.4 mol/L | D. | 0.5 mol/L |
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol羟基中电子数为10NA | |
| B. | 乙烯和环丙烷组成的21g混合气体中含有3NA个氢原子 | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 1molC2H6O分子中一定含有7 NA个极性共价键 |
10.下列溶液中导电性最强的是( )
| A. | 1L0.1mol/L醋酸 | B. | 0.1L 0.1mol/L H2SO4溶液 | ||
| C. | 0.5L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
20.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2 NA | |
| B. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
7.下列化学用语正确的是( )
| A. | 苏打--NaHCO3 | |
| B. | 硫原子的结构示意图  | |
| C. | 质量数为137的钡原子:${\;}_{137}^{56}$Ba | |
| D. | 硫酸铁的电离方程式 Fe2(SO4)3═2Fe3++3SO42- |