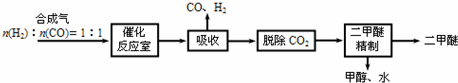
题目内容
18.合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol
H2O(g)═H2O(l)△H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式:CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.2KJ/mol.
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+2H2O(g)?CO2(g)+4H2 (g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍.
则①平衡时,CH4的转化率为50%,H2的浓度为0.4mol/L,反应共放出或吸收热量165.2KJ.
②升高平衡体系的温度,混合气体的平均相对分子质量变小,密度不变.(填“变大”“变小”或“不变”).
③当达到平衡时,充入氩气,并保持压强不变,平衡将正向(填“正向”“逆向”或“不”)移动.
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将逆向(填“正向”“逆向”或“不”)移动.达到新平衡后,容器内H2浓度范围为0.4mol/L<c(H2)<0.8mol/L.
分析 (1)①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol
③H2O(g)═H2O(l)△H=-44KJ/mol
根据盖斯定律①-②×2+③×2进行计算;
(2)①根据CH4(g)+2H2O(g)?CO2(g)+4H2 (g)反应,列三段式进行计算;
②根据(1)的分析,该反应为吸热反应,升高平衡体系的温度,平衡向正反应方向移动,根据$\overline{M}$=$\frac{m总}{n总}$和ρ=$\frac{m}{V}$进行判断;
③充入氩气,并保持压强不变,则体积增大,相当于反应体系的压强减小,平衡向气体体积增大的方向移动;
④保持恒温,将容器压缩为5L(各物质仍均为气态)即增大压强,平衡将向气体体积减小的方向移动,但氢气的浓度仍然增大.
解答 解:(1)①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol
③H2O(g)═H2O(l)△H=-44KJ/mol
根据盖斯定律①-②×2+③×2得CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.2KJ/mol;
故答案为:CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.2KJ/mol.
(2)①平衡时容器的压强是起始时的1.4倍,恒温恒容时,气体压强之比=气体物质的量之比.设甲烷转化的浓度为xmol/L,根据三段式:
CH4(g)+2H2O(g)?CO2(g)+4H2 (g)
开始(mol/L) 0.2 0.3 0 0
转化(mol/L) x 2x x 4x
平衡(mol/L)0.2-x 0.3-2x x 4x
则有,$\frac{0.2-x+0.3-2x+x+4x}{0.2+0.3}$=1.4,解得x=0.1,所以CH4的转化率为$\frac{0.1}{0.2}$×100%=50%,H2的浓度为0.1×4=0.4mol/L,反应共吸收热量0.1mol/L×10L×165.2KJ/mol=165.2KJ.
故答案为:50%;0.4mol/L;165.2
②根据(1)的分析,该反应为吸热反应,升高平衡体系的温度,平衡向正反应方向移动即总物质的量增大,又总质量不变,所以$\overline{M}$=$\frac{m总}{n总}$变小,总体积又没变,所以ρ=$\frac{m}{V}$不变.
故答案为:变小;不变
③充入氩气,并保持压强不变,则体积增大,相当于反应体系的压强减小,平衡向气体体积增大即正反应的方向移动.
故答案为:正向
④保持恒温,将容器压缩为5L(各物质仍均为气态)即增大压强,平衡将向气体体积减小即逆反应的方向移动,当将容器压缩为5L时氢气的瞬间浓度变为0.8mol/L,但平衡将向气体体积减小即逆反应的方向移动;氢气浓度再减小但最终达平衡时仍然大于原来的浓度0.4mol/L,所以达到新平衡后,容器内H2浓度范围为
0.4mol/L<c(H2)<0.8mol/L.
故答案为:逆向;0.4mol/L<c(H2)<0.8mol/L
点评 本题考查盖斯定律的应用、转化率的计算、平衡浓度、平衡移动原理等知识,题目难度中等,注意掌握化学平衡移动原理及影响因素.

 阅读快车系列答案
阅读快车系列答案步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时,用去NaOH标准溶液的体积将无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
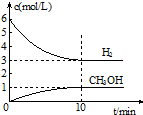 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )| A. | 0~10min内v(H2)=0.3 mol•L-1•min-1 | |
| B. | T℃时,平衡常数K=$\frac{1}{27}$,CO2与H2的转化率相等 | |
| C. | T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量 | |
| D. | 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
(1)选用的指示剂是甲基橙,滴定终点的颜色变化为甲基橙.
(2)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
A.观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
B.若将锥形瓶用待测液润洗,然后再加入25.00mL待测液,则滴定结果偏高.
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失偏高
D.锥形瓶内溶液颜色出现变色,立即记下滴定管内液面所在刻度偏低
(4)若用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中可能出现的结果是ABD
A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+) D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
(5)若25℃时,将a mol/L的氨水与0.10mol/L的盐酸等体积混合,溶液中
c(NH4+ )=c(Cl-).则溶液显中性(填“酸”、“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |