题目内容
20.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲溶液中SO42ˉ向铜片做定向移动 | |
| C. | 装置乙中电子从铜片经导线流向锌片 | |
| D. | 装置乙中正极的电极反应式:2H++2eˉ═H2↑ |
分析 锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
解答 解:A.甲没有形成原电池,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故A错误;
B.甲没有形成原电池,只有氢离子和锌的反应,故B错误;
C.锌为负极,电子从锌经导线流向铜,故C错误;
D.透过为正极,正极上氢离子得到电子被还原生成氢气,故D正确.
故选D.
点评 该题是高考中的常见题型,属于中等难度的试题.侧重考查学生灵活运用原电池原理解决实际问题的能力.学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题.

练习册系列答案
相关题目
10.下列对应化学反应的离子方程式正确的是( )
| A. | KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | Na[Al(OH)4]-溶液中通入过量CO2制Al(OH)3:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
8.Na2CO3+CO2+H2O═2NaHCO3的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
15.下列物质的制备,不符合工业生产实际的是( )
| A. | 工业上用电解熔融氯化镁制单质镁 | |
| B. | 工业上用电解饱和食盐水制氯气 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
5.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 分子数为NA的CO和C2H4混合气体的体积约为22.4 L | |
| B. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH${\;}_{4}^{+}$的数目为0.3NA |
12.下列说法或表述中正确的是( )
| A. | 烷烃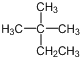 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
6.按要求完成下列实验报告:
实验名称:氯水的性质实验
实验目的:验证氯水:①有酸性,②有漂白性(氧化性),③存在Cl-
实验用品:主要仪器用品:试管、胶头滴管.
选用试剂:新制的饱和氯水、NaOH溶液、滴有酚酞的NaOH溶液,请添加其他必需试剂:品红溶液、硝酸银溶液、稀硝酸.
实验步骤:依次验证氯水的上述三项化学性质.
实验记录表:
实验探究:如果你在步骤①中使用了滴有酚酞的NaOH溶液,如何验证步骤①中氯水是否表现出漂白性?
实验名称:氯水的性质实验
实验目的:验证氯水:①有酸性,②有漂白性(氧化性),③存在Cl-
实验用品:主要仪器用品:试管、胶头滴管.
选用试剂:新制的饱和氯水、NaOH溶液、滴有酚酞的NaOH溶液,请添加其他必需试剂:品红溶液、硝酸银溶液、稀硝酸.
实验步骤:依次验证氯水的上述三项化学性质.
实验记录表:
| 步骤编号 | 操作过程 | 实验现象 | 实验结论 |
| ① | 氯水有酸性 | ||
| ② | 氯水有漂白性 | ||
| ③ | 氯水中存在Cl- |
7.下列各图象中,横坐标为向某溶液中加(通)入某反应物的物质的量,纵坐标为沉淀物的量,则下列叙述中正确的是( )
| A. |  向氯化铝溶液中加入过量的氨水 | |
| B. | 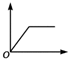 向饱和石灰水中通入过量的CO2气体 | |
| C. |  向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量 | |
| D. | 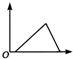 向含少量NaOH的偏铝酸钠溶液中通入过量的HCl气体 |
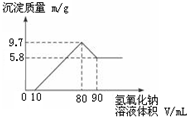 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.