题目内容
①温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
pH=6.②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7.下列说法中不正确的有( )
pH=6.②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7.下列说法中不正确的有( )
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:等体积等浓度的盐酸和MOH恰好反应生成盐,其溶液呈酸性,说明MOH是弱碱,如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,则溶液中存在等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,说明MOH的电离程度<M+的水解程度,结合电荷守恒和质子守恒分析.
解答:
解:A.①根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故A正确;
B.根据质子守恒得c(H+)=c(MOH)+c(OH-),所以c(H+)-c(MOH)=c(OH-)=1×10-8mol/L,故B正确;
C.取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,则溶液中存在等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,说明MOH的电离程度<M+的水解程度,故C正确;
D.混合溶液呈电中性,所以c(M+)+c(H+)=c(Cl-)+c(OH-),溶液呈酸性,所以c(H+)>c(OH-),则c(Cl-)>c(M+),故D错误;
故选D.
B.根据质子守恒得c(H+)=c(MOH)+c(OH-),所以c(H+)-c(MOH)=c(OH-)=1×10-8mol/L,故B正确;
C.取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,则溶液中存在等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,说明MOH的电离程度<M+的水解程度,故C正确;
D.混合溶液呈电中性,所以c(M+)+c(H+)=c(Cl-)+c(OH-),溶液呈酸性,所以c(H+)>c(OH-),则c(Cl-)>c(M+),故D错误;
故选D.
点评:本题考查了酸碱混合溶液的定性判断,根据物料守恒、电荷守恒和质子守恒来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
| B、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量的CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4的溶解度比在水中的大 |
| C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸中,待产生氢气的速率速率突然减小,可以判断锌镀层已反应完全 |
| D、标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |
设NA为阿伏伽德罗常数,下列说法正确的是( )
| A、0.1L 1mol/L的AlCl3溶液中Al3+数是0.1NA |
| B、标准状况下,2.24L甲烷分子的电子数是NA |
| C、25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数是0.2 NA |
| D、0.1L 1mol/L的醋酸溶液中的分子数是0.1NA |
离子方程式:CO32-+2H+═CO2↑+H2O可表示的意义是( )
| A、碳酸盐和盐酸反应生成CO2和水 |
| B、碳酸盐和强酸反应生成CO2和水 |
| C、可溶性碳酸盐和强酸反应生成CO2和水 |
| D、可溶性酸式碳酸盐和强酸反应生成CO2和水 |
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
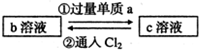
 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5.
已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5.

 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.