题目内容
 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.(1)阳极电极反应方程式
(2)理论上阴极生成的气体在标准状况下的体积为
(3)已知:酸性条件下Cr3+ 不与S2-反应.某研究小组设计实验回收含该电镀废液(主要含Cu2+,Cr3+,
Cr2O72-)中的铬,所用到的试剂有Na2SO3,Na2S,NaOH[铬以Cr(OH)3形式回收],写出该小组的实验方案所涉及到的离子方程式:
(4)上述实验铬的回收效率与NaOH的用量有关,如图所示,则反应Cr(OH)3+OH-?Cr(OH)
- 4 |
K=
考点:电解原理
专题:电化学专题
分析:(1)电解时阳极上氢氧根离子放电;
(2)铜电极上质量增加,说明铜电极上有铬析出,根据铬的质量计算转移电子数,铬得到的电子数小于60mol,所以阴极上还有氢气生成,根据氢气和转移电子的关系水解氢气的体积;
(3)亚硫酸根离子具有还原性,能被Cr2O72-氧化生成硫酸根离子,铜离子和硫离子反应生成硫化铜沉淀,铬离子和氢氧根离子反应生成氢氧化铬沉淀;
(4)当pH=12时,残留的铬离子的浓度是2.6mg/L,根据平衡常数公式计算;根据残留浓度确定溶液合适的pH.
(2)铜电极上质量增加,说明铜电极上有铬析出,根据铬的质量计算转移电子数,铬得到的电子数小于60mol,所以阴极上还有氢气生成,根据氢气和转移电子的关系水解氢气的体积;
(3)亚硫酸根离子具有还原性,能被Cr2O72-氧化生成硫酸根离子,铜离子和硫离子反应生成硫化铜沉淀,铬离子和氢氧根离子反应生成氢氧化铬沉淀;
(4)当pH=12时,残留的铬离子的浓度是2.6mg/L,根据平衡常数公式计算;根据残留浓度确定溶液合适的pH.
解答:
解:(1)电解时阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(2)铜电极上质量增加,说明铜电极上有铬析出,析出的铬得到电子的物质的量=
×3=19.5mol<60mol,所以阴极上还有氢气生成,生成氢气的体积=
×22.4L/mol=408.8L,
故答案为:408.8;
(3)亚硫酸根离子具有还原性,能被Cr2O72-氧化生成硫酸根离子,铜离子和硫离子反应生成硫化铜沉淀,铬离子和氢氧根离子反应生成氢氧化铬沉淀,所以涉及的离子反应方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,Cu2++S2-═CuS↓,Cr3++3OH-═Cr(OH)3↓,
故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,Cu2++S2-═CuS↓,Cr3++3OH-═Cr(OH)3↓;
(4)当pH=12时,残留的铬离子的浓度是2.6mg/L,平衡常数K=
=5×10-3,
当溶液的pH=9.5时铬离子浓度最小,所以应调节溶液的pH=9.5,
故答案为:5×10-3;调节溶液的pH值为9.5.
故答案为:4OH--4e-=O2↑+2H2O;
(2)铜电极上质量增加,说明铜电极上有铬析出,析出的铬得到电子的物质的量=
| 338g |
| 52g/mol |
| (56-19.5)mol |
| 2 |
故答案为:408.8;
(3)亚硫酸根离子具有还原性,能被Cr2O72-氧化生成硫酸根离子,铜离子和硫离子反应生成硫化铜沉淀,铬离子和氢氧根离子反应生成氢氧化铬沉淀,所以涉及的离子反应方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,Cu2++S2-═CuS↓,Cr3++3OH-═Cr(OH)3↓,
故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,Cu2++S2-═CuS↓,Cr3++3OH-═Cr(OH)3↓;
(4)当pH=12时,残留的铬离子的浓度是2.6mg/L,平衡常数K=
| ||
| 0.01mol/L |
当溶液的pH=9.5时铬离子浓度最小,所以应调节溶液的pH=9.5,
故答案为:5×10-3;调节溶液的pH值为9.5.
点评:本题考查了电解原理及离子方程式的书写,注意(2)题中阴极上不仅析出金属单质,还析出氢气,要根据转移电子守恒确定是否产生氢气,为易错点.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
下列物质中属于电解质的是( )
| A、酒精 | B、氯气 |
| C、碳酸钠 | D、硫酸溶液 |
设NA代表阿伏加德罗常数的值,下列说法不正确的是( )
| A、阿伏加德罗常数NA是0.012 kg l2C中所含的原子数 |
| B、2g氢气所含氢原子数目为NA |
| C、标准状况下,11.2 L NH3所含的原子数目为0.5 NA |
| D、含71 g Na2SO4的溶液中所含Na+离子数目为NA |
①温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
pH=6.②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7.下列说法中不正确的有( )
pH=6.②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7.下列说法中不正确的有( )
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |

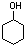 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
 一种将CO2变为燃料或有机化学品的构想分成3个步骤:
一种将CO2变为燃料或有机化学品的构想分成3个步骤: 〔化学--选修3:物质结构与性质〕
〔化学--选修3:物质结构与性质〕