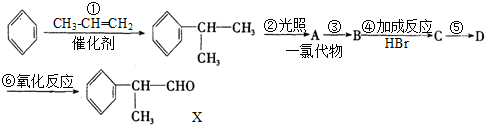
题目内容
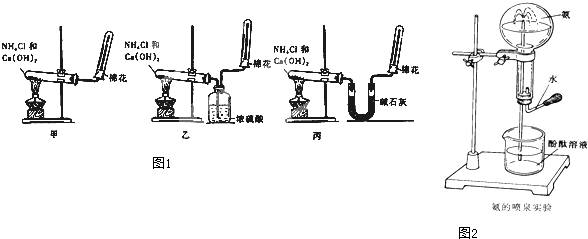
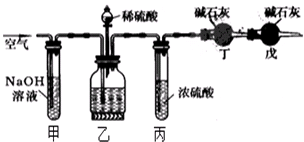 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.(1)甲装置的作用是
(2)乙装置反应结束后再通数分钟空气的作用是
(3)若去掉丙装置,测得的CO2质量会
(4)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为w,则Na2CO3质量分数的计算式为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)实验装置中会残留部分二氧化碳,影响丁中二氧化碳质量的测定,需要通入空气将装置内的二氧化碳完全排入丁中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;
空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,戊装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置丁中;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后应再通空气,排尽装置内的二氧化碳,使之被丁装置吸收;装置甲中二氧化碳与氢氧化钠反应生成碳酸钠与水;
(3)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大;
(4)由题意可知,反应生成的二氧化碳的质量为(w-m)g,计算二氧化碳的物质的量,根据碳元素守恒二氧化碳的物质的量等于样品中碳酸钠的物质的量,计算样品中碳酸钠的质量,再利用质量分数的定义计算.
空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,戊装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置丁中;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后应再通空气,排尽装置内的二氧化碳,使之被丁装置吸收;装置甲中二氧化碳与氢氧化钠反应生成碳酸钠与水;
(3)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大;
(4)由题意可知,反应生成的二氧化碳的质量为(w-m)g,计算二氧化碳的物质的量,根据碳元素守恒二氧化碳的物质的量等于样品中碳酸钠的物质的量,计算样品中碳酸钠的质量,再利用质量分数的定义计算.
解答:
解:(1)实验装置中会残留部分二氧化碳,影响丁中二氧化碳质量的测定,需要通入空气将装置内的二氧化碳完全排入丁中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定,装置甲的作用是吸收空气中的二氧化碳;
空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,戊装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置丁中,
故答案为:吸收空气中的二氧化碳;吸收空气中二氧化碳中和水蒸气,防止进入装置丁中;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后再通空气,排尽装置内的二氧化碳,使之全部被丁装置吸收,装置甲中空气中二氧化碳碳与氢氧化钠反应生成碳酸钠与水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,
故答案为:排出装置中的二氧化碳气体,使之都被丁处碱石灰完全吸收;2NaOH+CO2=Na2CO3+H2O;
(3)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大,导致测定的样品中碳酸钠的质量增大,测定的碳酸钠质量分数偏大,故答案为:偏大;
(4)由题意可知,反应生成的二氧化碳的质量为(w-m)g,二氧化碳的物质的量为
=
mol,根据碳元素守恒可知样品中碳酸钠的物质的量为
mol,样品中碳酸钠的质量为
mol×106g/mol=
g,样品中碳酸钠质量分数为
×100%=
×100%,
故答案为:
×100%.
空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,戊装置的作用是吸收空气中二氧化碳中和水蒸气,防止进入装置丁中,
故答案为:吸收空气中的二氧化碳;吸收空气中二氧化碳中和水蒸气,防止进入装置丁中;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后再通空气,排尽装置内的二氧化碳,使之全部被丁装置吸收,装置甲中空气中二氧化碳碳与氢氧化钠反应生成碳酸钠与水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,
故答案为:排出装置中的二氧化碳气体,使之都被丁处碱石灰完全吸收;2NaOH+CO2=Na2CO3+H2O;
(3)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大,导致测定的样品中碳酸钠的质量增大,测定的碳酸钠质量分数偏大,故答案为:偏大;
(4)由题意可知,反应生成的二氧化碳的质量为(w-m)g,二氧化碳的物质的量为
| (w-m)g |
| 44g/mol |
| w-m |
| 44 |
| w-m |
| 44 |
| w-m |
| 44 |
| 53(w-m) |
| 22 |
| ||
| ng |
| 53(w-m) |
| 22n |
故答案为:
| 53(w-m) |
| 22n |
点评:本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、化学计算等,难度中等,根据物质的化学性质,要认真分析,把握实验设计的每个步骤中的实验目的.

练习册系列答案
相关题目
己烯雌酚是一种激素类药物,结构如 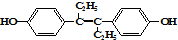 下列叙述中正确的是( )
下列叙述中正确的是( )
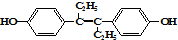 下列叙述中正确的是( )
下列叙述中正确的是( )| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、该分子中有2个H,2个O,6个C共直线 |
下列操作会引起实验误差的是( )
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度的盐酸所用的0.5mol?L-1 NaOH溶液时,用甲基橙为指示剂,在配制标准溶液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往用蒸馏水洗净的滴定管中直接加入待测液,再注入锥形瓶中 |

 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和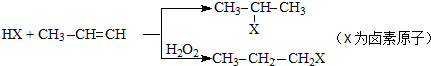
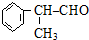 ,该物质是一种香料.
,该物质是一种香料.