题目内容
NaHCO3受热容易分解为Na2CO3. 现加热5.00g的NaHCO3和Na2CO3的混合物,使NaHCO3完全分解,混合物质量减少了0.31g,则原混合物中Na2CO3的质量为( )
| A、3.38g |
| B、34.58g |
| C、4.16g |
| D、34.41g |
考点:有关混合物反应的计算
专题:计算题
分析:加热碳酸钠和碳酸氢钠的混合物,碳酸氢钠完全分解,根据反应的方程式2NaHCO3
Na2CO3+CO2↑+H2O↑,利用差量法计算出原混合物中碳酸氢钠的质量,再计算出碳酸钠的质量.
| ||
解答:
解:碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,
设混合物中含有xgNaHCO3,则
2NaHCO3
Na2CO3+CO2↑+H2O↑△m
2×84 62
xg 0.31g
解得:x=0.84g,
所以原混合物中碳酸钠的质量为:m(Na2CO3)=5g-m(NaHCO3)=5g-0.84g=4.16g,
故选C.
设混合物中含有xgNaHCO3,则
2NaHCO3
| ||
2×84 62
xg 0.31g
解得:x=0.84g,
所以原混合物中碳酸钠的质量为:m(Na2CO3)=5g-m(NaHCO3)=5g-0.84g=4.16g,
故选C.
点评:本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意碳酸氢钠的性质,利用差量法结合化学方程式计算.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A、溴苯中的溴(苯) |
| B、溴乙烷中的乙醇(水) |
| C、乙烷中的乙烯(酸性KMnO4溶液) |
| D、苯中的甲苯(溴水) |
往盛氯水的试管里滴入少量紫色石蕊试液,观察到的现象是( )
| A、紫色石蕊试液显蓝色 |
| B、紫色石蕊试液显红色 |
| C、紫色石蕊试液的颜色消失 |
| D、紫色石蕊试液先显红色,后红色消失 |
某无色溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-22( 25℃),下列离子组在此溶液中能大量共存的是( )
| A、MnO4- Cl- NH4+ Na+ |
| B、CO32- NO3- Ca2+Na+ |
| C、SO42- HCO3- K+ Na+ |
| D、SO42-NO3-K+ Na+ |
如图所示铜锌电池,下列叙述错误的是( )
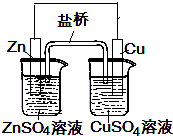

| A、锌是负极,发生氧化反应 |
| B、铜是正极,发生还原反应 |
| C、电流是从Zn流出经导线流入铜电极 |
| D、锌电极质量减少,铜电极质量增加 |
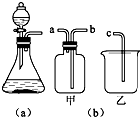 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和
